高三化学第四套
化学与生活息息相关,下列说法不正确的是
| A.用食醋可除去热水壶内壁的水垢 |
| B.淀粉、油脂和蛋白质都是高分子化合物 |
| C.自行车钢架生锈主要是电化学腐蚀所致 |
| D.新型复合材料使手机、电脑等电子产品更轻巧、实用和新潮 |
设阿伏加德罗常数为NA,则下列说法正确的是
| A.78g过氧化钠晶体中,含2 NA个阴离子 |
| B.a gO2和O3的混合气体中含有的分子总数为aNA/32 |
| C.常温常压下,28 gCO和N2的混合气体中含有的分子总数为NA |
| D.标准状况下,22.4 L H2S和SO2的混合气体中含有的分子总数为NA |
下列说法正确的是
| A.油脂饱和程度越大,熔点越低 |
| B.氨基酸、二肽、蛋白质均既能跟强酸反应又能跟强碱反应 |
| C.蔗糖、麦芽糖、硬脂酸甘油酯酸性水解都能得到2种物质 |
D.麻黄碱( )的催化氧化产物能发生银镜反应 )的催化氧化产物能发生银镜反应 |
下列表示对应化学反应的离子方程式正确的是
| A.用氯化铁溶液腐蚀铜板:Cu+Fe3+=Cu2++Fe2+ |
| B.碘水中通入适量的SO2:I2+SO2+2H2O=2I-+SO42-+4H+ |
| C.硝酸银溶液中滴加过量氨水:Ag++NH3·H2O=AgOH↓+NH4+ |
| D.往KAl(SO4)2溶液中滴入Ba(OH)2溶液至沉淀的物质的量最大:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O |
下列实验现象与对应结论均正确的是
| 选项 |
操作 |
现象 |
结论 |
| A |
常温下将Cu片放入浓H2SO4中 |
生成刺激性气味气体 |
Cu与浓H2SO4反应生成SO2 |
| B |
Al2(SO4)3溶液中滴加过量氢氧化钡溶液 |
生成白色沉淀 |
Al(OH)3不溶于氢氧化钡溶液 |
| C |
向某溶液中加入KSCN溶液,再向溶液中加入新制氯水 |
溶液先不显红色,加入氯水后变红色 |
该溶液中含有Fe2+ |
| D |
向某溶液中加入CCl4,振荡后静置 |
液体分层,下层呈紫红色 |
该溶液中存在I- |
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图),下列说法正确的是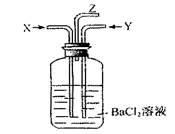
A.洗气瓶中产生的沉淀是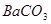 |
B.在Z导管出来的气体中无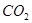 |
C.洗气瓶中产生的沉淀是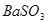 |
| D.在Z导管口有红棕色气体出现 |
短周期金属元素甲~丁在元素周期表中的相对位置如下表所示:
下列判断正确的是
| A.原子半径:丙<丁<乙 |
| B.单质的还原性:丁>丙>甲 |
| C.甲、乙、丙的氧化物均为共价化合物 |
| D.乙、丙、丁的最高价氧化物对应的水化物能相互反应 |
一定条件下,使X(g)与Y(g)在2L密闭容器中发生反应生成z(g)。温度为TK时,反应过程中X,Y,Z的物质的量变化如图1所示;若保持其他条件不变,温度分别为T, K和T2 K时,Y的体积分数与时间的关系如图2所示。则下列结论正确的是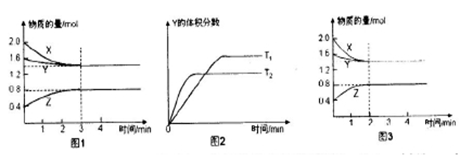
| A.反应进行的前3 min内,用X表示的反应速率V(X)=0.1 mol/(L·min) |
B.平衡时容器内的压强为反应前的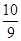 倍 倍 |
| C.保持其他条件不变,升高温度,反应的化学平衡常数K减小 |
| D.若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强 |
在下列实验中,不能达到目的的是
| A.Fe与Cl2反应生成FeCl3,Fe与S反应生成FeS,确定非金属性:Cl>S |
| B.用石墨作电极电解Mg(NO3)2、Cu(NO3)2的混合溶液,确定铜和镁的金属活动性强弱 |
| C.进行H2O和H2S的热分解实验,确定硫和氧两种元素的非金属性强弱 |
| D.用pH试纸测定氯水的酸碱性 |
常温下,下列溶液中的微粒浓度关系正确的是
| A.新制氯水中加入固体NaOH:c(Na+)= c(Cl-)+ c(ClO-)+ c(OH‑) |
| B.pH = 8.3的NaHCO3溶液:c(Na+)> c(HCO3-)> c(CO32-)> c(H2CO3) |
| C.pH = 11的氨水与pH = 3的盐酸等体积混合:c(Cl-)= c(NH4+)> c(OH‑)= c(H+) |
| D.0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合:2c(H+)– 2c(OH-)= c(CH3COO-)– c(CH3COOH) |
β—紫罗兰酮是存在于玫瑰花、番茄等中的一种天然香料,它经多步反应可合成维生素A1。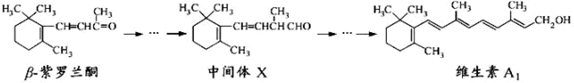
下列说法正确的是
| A.β—紫罗兰酮可使酸性KMnO4溶液褪色 |
| B.1mol中间体X最多能与2molH2发生加成反应 |
| C.维生素A1易溶于NaOH溶液 |
| D.β—紫罗兰酮与中间体X互为同分异构体 |
下列说法正确的是
| A.实验室从海带提取单质碘的方法是:取样→灼烧→溶解→过滤→萃取 |
| B.用乙醇和浓H2SO4制备乙烯时,可用水浴加热控制反应的温度 |
| C.氯离子存在时,铝表面的氧化膜易被破坏,因此含盐腌制品不宜直接放在铝制容器 |
| D.将(NH4)2SO4、CuSO4溶液分别加入蛋白质溶液,都出现沉淀,表明二者均可使蛋白质变性 |
Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法正确的是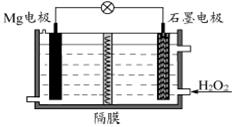
| A.Mg 电极是该电池的正极 |
| B.H2O2在石墨电极上发生氧化反应 |
| C.石墨电极附近溶液的pH 增大 |
| D.溶液中Cl-向正极移动 |
将一定质量的镁、铜合金加入到稀硝酸溶液中,两者恰好完全反应,假设反应过程中还原产物全部是NO,向所得溶液中加入物质的量浓度为3 mol·L-1的NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列有关叙述中正确的是
| A.生成沉淀完全时消耗NaOH溶液的体积为100mL |
| B.参加反应的硝酸的物质的量为0.1mol |
| C.开始加入合金的质量可能为16.4g |
| D.标况下产物NO的体积为22.4 L |
FeSO4·7H2O广泛用于医药和工业领域,以下是FeSO4·7H2O的实验室制备流程图。根据题意完成下列填空:

(1)铁屑与稀硫酸反应前,应用10% Na2CO3溶液浸泡几分钟,操作目的是_____,浸泡后,用__ __(填操作方法)分离并洗涤铁屑。
(2)操作a为_______________。
(3)最后得到的绿矾晶体用少量冰水洗涤,其目的是:
①除去晶体表面附着的硫酸等杂质;
②____________________。
(4)FeSO4·7H2O是某些补血剂的主要成分,实验室要测定某补血剂中铁元素的含量。
I.方案一:可用KMn04溶液进行氧化还原滴定。在配制100mL 1.00 × 10 - 2 mol·L-1的KMnO4溶液时,所用的仪器有天平、药匙、烧杯、玻璃棒,还有___________(填仪器名称)。在配制过程中,下列说法正确的是____________(填序号字母)。
| A.KMnO4溶于水不放热,可以直接在容量瓶中溶解 |
| B.容量瓶洗涤后不需干燥即可直接用于实验 |
| C.定容后摇匀,凹液面低于刻度线,再加水至凹液面最低点与刻度线相平 |
| D.如果定容时加水超过刻度线必须毓配制 |
II.方案二:将FeSO4·7H2O最终转化为Fe2O3,测定质量变化,操作流程如下:
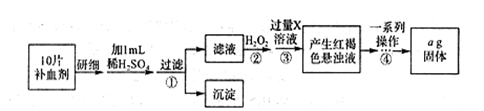
①步骤④中一系列操作依次是:过滤、洗涤、______、冷却、称量。
②假设实验过程中Fe无损耗,则每片补血剂含铁元素的质量______g(用含a的代数式表示)。
③若步骤③加入X溶液的量不足,则最后测出每片补血剂含铁元素的质量将______(填“偏大”、“偏小”或“不变”)。
氨是重要的化工产品和化工原料。
(1)氨的电子式是 。
(2)已知:
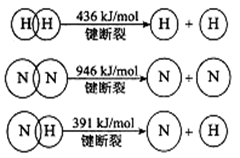
①合成氨的热化学方程式是 。
②降低温度,该反应的化学平衡常数K (填“增大”、“减小’’或“不变”)。
(3)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图l所示。
电池正极的电极反应式是 ,A是 。
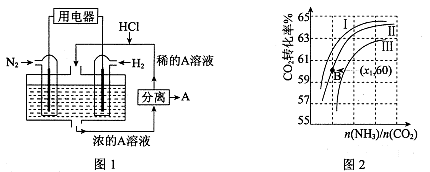
(4)用氨合成尿素的反应为2NH3(g)+CO2(g) CO(NH2)2(l)+ H2O(g)。工业生产时,原料气带有水蒸气。图2表示CO2的转化率与氨碳比
CO(NH2)2(l)+ H2O(g)。工业生产时,原料气带有水蒸气。图2表示CO2的转化率与氨碳比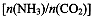 、水碳比
、水碳比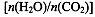 的变化关系。
的变化关系。
①曲线I、II、III对应的水碳比最大的是 。
②测得B点氨的转化率为40%,则x1 。
随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NOx、SO2、CO等大气污染气体的处理具体有重要意义。
(1)如图是在101 kPa,298K条件下1mol NO2和1mol CO反应生成1mol CO2和1mol NO过程中的能量变化示意图。
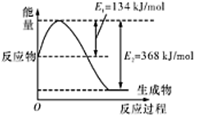
已知:
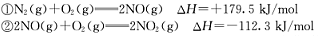
请写出NO与CO反应生成无污染气体的热化学方程式: 。
(2)将0.20 mol N02和0.10 mol CO充入一个容积恒定为1L的密闭容器中发生反应,在不同条件下,反应过程中部分物质的浓度变化状况如图所示。
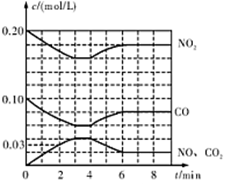
①下列说法正确的是 (填序号)。
a.容器内的压强不发生变化说明该反应达到乎衡
b.当向容器中再充人0.20 mol NO时,平衡向正反应方向移动,K增大
c.升高温度后,K减小,N02的转化率减小
d.向该容器内充人He气,反应物的体积减小,浓度增大,所以反应速率增大
②计算产物NO在0~2 min内平均反应速率v(NO)= mol·L-1·min-1
③第4 min时改变的反应条件为 (填“升温”、“降温”)。
④计算反应在第6 min时的平衡常数K= 。若保持温度不变,此时再向容器中充人CO、NO各0.060 mol,平衡将 移动(填“正向”、“逆向”或“不”)。
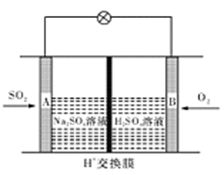
(3)有学者想以如图所示装置用原电池原理将SO2转化为重要的化工原料。其负极反应式为 ,当有0.25 mol SO2被吸收,则通过质子(H+)交换膜的H+的物质的量为 mol。
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式。
(1)甲烷燃烧放出大量的热,可作为能源用于人类的生产和生活。
已知:①2CH4(g)+3O2(g)=2CO(g)+4H2O(l) △H=" —1214" kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H=" —566" kJ/mol
则表示甲烷燃烧热的热化学方程式 。
(2)将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。其负极电极反应式是: 。
(3)某同学利用甲烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如下图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中正确的是 (填序号)
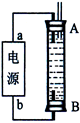
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H+ + 2e-= H2↑
(4)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
得到如下三组数据:
| 实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
|
| H2O |
CO |
CO2 |
|||
| 1 |
650 |
2 |
4 |
1.6 |
5 |
| 2 |
900 |
1 |
2 |
0.4 |
3 |
| 3 |
900 |
1 |
2 |
0.4 |
1 |
①实验1中,以v (H2)表示的平均反应速率为 。
②实验3跟实验2相比,改变的条件可能是 (答一种情况即可)
有机物F是一种新型涂料固化剂,可由下列路线合成(部分反应条件略去):
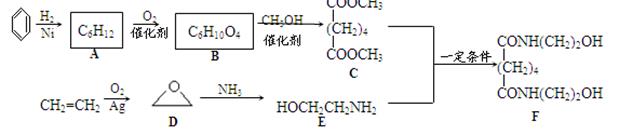
(1)B的结构简式是 ;E中含有的官能团名称是 。
(2)由C和E合成F的化学方程式是 。
(3)同时满足下列条件的苯的同分异构体的结构简式是 。
①含有3个双键;
②核磁共振氢谱只显示1个吸收峰;
③不存在甲基。
(4)乙烯在实验室可由 (填有机物名称)通过 (填反应堆类型)制备。
(5)下列说法正确的是 。
a.A属于饱和烃 b.D与乙醛的分子式相同
c.E不能与盐酸反应 d.F可以发生酯化反应
下图为某套实验装置示意图,其中加热装置和部分药品等均已经省略(装置①和装置②为气体发生装置)。
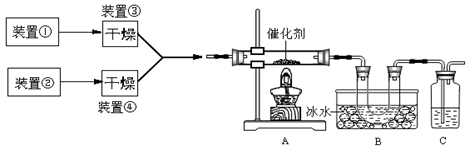
(1)甲同学用此装置(在A、B间增加一盛有浓硫酸的洗气瓶)制备NO2并验证其性质。装置①用于实验室制备NH3,用装置②制备过量O2。装置①中发生反应的化学方程式是 。B处冰水冷却的U型管中有红棕色气体生成且越接近U型管底部颜色越浅,请解释原因 。
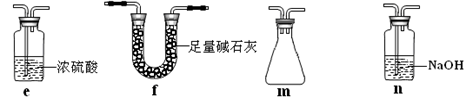
(2)乙同学用此套装置合成SO3,B处冰水冷却的U型管中有固体出现。C中若盛放酸性K2Cr2O7溶液,则在C中发生的氧化还原反应的离子方程式是 (生成物中Cr以Cr3+形式存在);现欲制得纯净干燥的SO3,若C中盛放NaOH溶液,则此装置中存在明显不足,应如何改进 (从下面给出的实验装置中选择字母标号补充或替换,并用简要文字说明补充和替换的位置)。
(3)丙同学拟验证NO能被氨气还原并测算其转化率(装置①、装置②分别制NO和NH3),将上述装置A、B、C分别换成下列⑤、⑥、⑦。
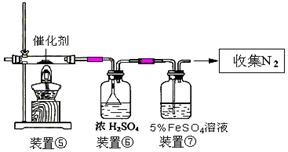
请回答:装置⑦的作用可能是 ;若进入装置⑤的NO共22.4L(已折算为标准状况,下同),氨气过量,最后收集到标准状况下11.2LN2,则NO的转化率是 。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号