高二化学第四套
下列有关元素的性质及其递变规律正确的是
| A.ⅠA族与ⅦA族元素间可形成共价化合物或离子化合物 |
| B.第二周期元素从左到右,最高正价从+1递增到+7 |
| C.同主族元素的简单阴离子还原性越强,水解程度越大 |
| D.同周期金属元素的化合价越高,其原子失电子能力越强 |
以下有关原子结构及元素周期律的叙述正确的是
A.以ⅠA族元素铯的两种同位素 比 比 多4个质子 多4个质子 |
| B.同周期元素(除0族元素外)从左到右,原子半径逐渐减小 |
| C.第ⅦA族元素从上到下,其氢化物得稳定性逐渐增强 |
| D.同主族元素从上到下,单质的熔点逐渐降低 |
下列说法错误的是
| A.含有共价键的化合物一定是共价化合物 |
| B.共价化合物中一定含有共价键 |
| C.含有离子键的化合物一定是离子化合物 |
| D.离子化合物中可能含有共价键 |
实验室制备下列气体时,所用方法正确的是
| A.制氧气时,用Na2O2或H2O2作反应物可选择相同的气体发生装置 |
| B.制氯气时,用饱和NaHCO3溶液和浓硫酸净化气体 |
| C.制乙烯时,用排水法或向上排空气法收集气体 |
| D.制二氧化氮时,用水或NaOH溶液吸收尾气 |
实验室欲制氢气,所用稀盐酸和稀硫酸的浓度相同,反应速率最快的是
| A.纯锌与稀硫酸反应 | B.纯锌和浓硫酸反应 |
| C.纯锌与稀盐酸反应 | D.粗锌(含铅、铜杂质)与稀硫酸反应 |
对于放热反应H2+Cl2=2HCl,下列说法中,正确的是
| A.产物所具有的总能量高于反应物所具有的总能量 |
| B.反应物所具有的总能量高于产物所具有的总能量 |
| C.断开1 mol H-H键和1 mol Cl-Cl键所吸收的总能量大于形成2mol H-Cl键所放出的能量 |
| D.该反应中,化学能只转变为热能 |
aX(g)+bY(g) cZ(g)+dW(g)在一定体积的密闭容器中反应5 min达到平衡时,X减少n mol·L-1,Y减少
cZ(g)+dW(g)在一定体积的密闭容器中反应5 min达到平衡时,X减少n mol·L-1,Y减少 mol·L-1,Z增加
mol·L-1,Z增加 mol·L-1。若将体系压强增大,W的百分含量不发生变化。则化学方程式中各物质的化学计量数之比a∶b∶c∶d应为
mol·L-1。若将体系压强增大,W的百分含量不发生变化。则化学方程式中各物质的化学计量数之比a∶b∶c∶d应为
| A.3∶1∶2∶1 | B.1∶3∶2∶2 |
| C.3∶1∶2∶2 | D.1∶3∶1∶2 |
反应C(s)+H2O(g)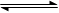 CO(g)+ H2(g)在一体积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
CO(g)+ H2(g)在一体积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
| A.保持体积不变,充入H2使体系压强增大 |
| B.将容器体积缩小一倍 |
| C.增加C的量 |
| D.保持压强不变,充入N2使体系体积增大 |
能够证明甲烷分子空间结构为正四面体的事实是
| A.甲烷的四个碳氢键的键能相等 |
| B.甲烷的四个碳氢键的键长相等 |
| C.甲烷的一氯代物只有一种 |
| D.甲烷的二氯代物只有一种 |
对于反应:H-+NH3=H2+NH2-,下列说法正确的是
| A.属于置换反应 | B.H-既是氧化剂又是还原剂 |
| C.NH3既是氧化剂又是还原剂 | D.H2既是氧化产物又是还原产物 |
下列关于有机物的说法正确的是
| A.迄今有机化合物种类已达几千万种,远远高于无机物,但碳在地壳中含量却不是很高 |
| B.有机物种类繁多的一个重要原因是同系物现象的存在 |
| C.有机物与我们生活息息相关,石油、甘油、豆油;清洁剂、粘合剂、干燥剂;人造纤维、合成纤维、光导纤维都是有机物 |
| D.组成有机物的元素除碳外还有氢、氧、氮、硫、卤素、磷等,NH4OCN、CCl4、CS2都是有机物 |
如图是四种常见有机物的比例模型示意图。下列说法正确的是
| A.甲能使酸性高锰酸钾溶液褪色 |
| B.乙可与酸性高锰酸钾发生加成反应 |
| C.丙中的碳碳键是介于碳碳单键和碳碳双键之间的独特的键 |
| D.丁可与乙酸发生中和反应 |
下列方程式表示的反应既不属于加成反应也不属于取代反应的是
| A.C6H5CH2Cl+NaCN → C6H5CH2CN+NaCl |
| B.C6H5Li+CO2 → C6H5COOLi |
| C.CH3CH2CHO+HCN→CH3CH2CH(CN)OH |
D.CH3COOCH2CH3 CH3COOH+CH2=CH2 CH3COOH+CH2=CH2 |
分别将下列各组物质等体积混合,在室温下剧烈振荡,静置后能够形成均匀溶液的是
| A.乙酸乙酯、水 | B.苯、水 |
| C.乙醇、水 | D.四氯化碳、碘水 |
书法离不开文房四宝(笔、墨、纸、砚),做笔用的狼毫,研墨用的墨条以及宣纸(即白纸)和做砚台用的砚石的主要成份依次是
| A.多糖、石墨、蛋白质、无机盐 |
| B.塑料、石墨、多糖、无机盐 |
| C.蛋白质、炭黑、多糖、无机盐 |
| D.蛋白质、煤炭、多糖、有机玻璃 |
锌电池有望代替铅蓄电池,它的构成材料是锌、空气、某种电解质溶液,发生的总反应式是2Zn+O2==2ZnO。下列有关它的说法正确的是
| A.锌为电池负极,发生氧化反应 |
| B.电解质溶液是酸性溶液 |
| C.电池工作时,氧气与锌直接化合,生成氧化锌 |
| D.负极发生的反应是:Zn-2e-+H2O=ZnO+2H+ |
锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是
| A.铜电极上发生氧化反应 |
| B.电池工作一段时间后,甲池的c(SO42-)减小 |
| C.电池工作一段时间后,乙池溶液的总质量增加 |
| D.阴阳离子离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡 |
质子交换膜燃料电池(PEMFC)常作为电动汽车的动力源。该燃料电池以氢气为燃料,空气为氧化剂,铂作催化剂,导电离子是H+。下列对该燃料电池的描述中正确的是
①正极反应为:O2+4H++4e- 2H2O
2H2O
②负极反应为:2H2-4e- 4H+
4H+
③总的化学反应为:2H2+O2 2H2O
2H2O
④氢离子通过电解质向正极移动
A.①②③ B.②③④ C.①②④ D.①②③④
工业上制备下列金属,采用的化学反应原理正确的是
A.镁:2MgO (熔融)  Mg+O2↑ Mg+O2↑ |
B.钙:CaO+C Ca+CO↑ Ca+CO↑ |
C.锰:3MnO2+4Al 3Mn+2Al2O3 3Mn+2Al2O3 |
D.汞:HgS Hg+S Hg+S |
形成节约能源和保护生态环境的产业结构是人类与自然和谐发展的重要保证,你认为下列行为中有悖于这一保证的是
| A.开发太阳能、水能、风能等新能源,减少使用煤、石油等化石燃料 |
| B.研究采煤、采油新技术,提高产量以满足工业生产的快速发展 |
| C.在农村推广使用沼气 |
| D.减少资源消耗、增加资源的重复使用和资源的循环再生 |
“绿色化学”特点之一是:提高原子的利用率,力图使所有作为原料的原子都被产品所消纳,实现“零排放”。以下反应不符合绿色化学原子经济民生要求的是
| A.乙烯聚合为聚乙烯高分子材料 |
| B.乙烯水化法制得乙醇 |
| C.乙烯与氯化氢反应制备一氯乙烷 |
| D.乙烯与氢气反应后,再与氯气光照制备一氯乙烷 |
(6分)随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。
根据判断出的元素回答问题:
(1)f在元素周期表的位置是__________。
(2)比较d、e常见离子的半径的小(用化学式表示,下同)_______>__________;比较g、h的最高价氧化物对应的水化物的酸性强弱是:_______>__________。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式__________。
元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是 。
a.原子序数和离子半径均减小
b.金属性减弱,非金属性增强
c.氧化物对应的水合物碱性减弱,酸性增强
d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为 ,氧化性最弱的简单阳离子是 。
(3)已知:
| 化合物 |
MgO |
Al2O3 |
MgCl2 |
AlCl3 |
| 类型 |
离子化合物 |
离子化合物 |
离子化合物 |
共价化合物 |
| 熔点/℃ |
2800 |
2050 |
714 |
191 |
工业制镁时,电解MgCl2而不电解MgO的原因是 ;制铝时,电解Al2O3而不电解AlCl3的原因是 。
(4)晶体硅(熔点1410℃)是良好的半导体材料。由粗硅制纯硅过程如下:

写出SiCl4的电子式: ;
(5)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是 。
a.NH3 b.HI c.SO2 d.CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式: 。
(1)在一密闭的2 L的容器里充入8 mol SO2和4 mol18O2,在一定条件下开始反应:
2SO2(g)+O2(g) 2SO3(g),2 min末测得容器中有7.2 mol SO2。试回答:
2SO3(g),2 min末测得容器中有7.2 mol SO2。试回答:
①反应后18O原子存在于哪些物质中________
②2 min末SO3的浓度为________
③用O2的浓度变化表示该时间段内的化学反应速率为________
(2)基本化工原料苯和乙烯,都有着十分广泛的用途。请回答:
①可以用来鉴别苯蒸气和乙烯的试剂是________(填序号)
A.水 B.溴的四氯化碳溶液
C.酸性高锰酸钾溶液 D.氢气
②苯分子具有平面正六边形结构,所有原子共平面,则苯分子中在一条直线上的原子最多有________个
(3)下列营养物质在人体内发生的变化及其对人的生命活动所起的作用不正确的是( )
A.人体中的糖类、油脂和蛋白质都能为人的生命活动提供能量
B.淀粉和纤维素 葡萄糖
葡萄糖 CO2和H2O(释放能量维持生命活动)
CO2和H2O(释放能量维持生命活动)
C.油脂 甘油和高级脂肪酸
甘油和高级脂肪酸 CO2和H2O(释放能量维持生命活动)
CO2和H2O(释放能量维持生命活动)
D.蛋白质 氨基酸
氨基酸 人体所需的蛋白质(人体生长发育、新陈代谢)
人体所需的蛋白质(人体生长发育、新陈代谢)
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯。

回答下列问题:
(1)写出制取乙酸乙酯的化学反应方程式
(2)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液的方法是 。
(3)浓硫酸的作用是:① ;② 。
(4)饱和碳酸钠溶液的主要作用是
(5)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止 。
(6)若要把制得的乙酸乙酯分离出来,应采用的实验操作是 。
(7)做此实验时,有时还向盛乙酸和乙醇的试管里加入几块碎瓷片,其目的是 。
(8)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号) 。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化
海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如图所示。
(1)指出提取碘的过程中有关的实验操作名称:①________________,③_______________。
写出实验②中有关反应的离子方程式:_________________________________。
(2)提取碘的过程中,可供选择的有关溶剂是________________________。
| A.甲苯,酒精 | B.四氯化碳,苯 |
| C.汽油,乙酸 | D.汽油,乙二醇 |
(3)为了使海藻灰中碘离子转化为碘的有机溶液,实验室准备了烧杯、玻璃棒、锥形瓶、酒精灯、导管、圆底烧瓶,石棉网以及必要的夹持仪器、物品。如上流程图所示,还缺少的玻璃仪器是_________________________。
(4)从含碘的有机溶液中提取碘和回收有机溶剂还需经过蒸馏,指出下图实验装置中的错误之处:
①______________________;
②__________________________;
③________________________。
(5)进行上述蒸馏法操作时,使用水浴的原因是_______________;最后,晶态碘在__________________里聚集。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号