安徽省合肥市高三第三次教学质量检测(理科综合化学)
现代无机化学对硫一氮化合物的研究是最为活跃的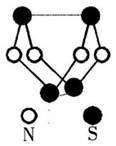
领域之一。其中右图是已经合成的最著名的硫一
氮化合物的分子结构。下列说法错误的是( )
| A.该物质的分子式为S4N4 |
| B.该物质与化合物s2N2互为同素异形体 |
| C.该物质的分子结构中含有极性键 |
D.该物质中所含化学键S—N键能小于N2中N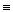 N键能 N键能 |
用M表示阿伏加德罗常数的数值,下列说法中一定正确的是 ( )
| A.1 L l mol·L-1的FeCl3溶液中含有NA个Fe3+ |
| B.4.8g镁与足量盐酸反应时,转移0.2 NA个电子 |
| C.钠与水反应生成1.12 L H2,反应中转移的电子数为0.1NA |
| D.常温常压下,22g氧气和26g臭氧混合气体所含氧原子总数为3NA |
如图所示,利用培养皿进行实验。实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面。
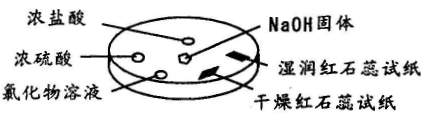 |
下表中对实验现象所做的解释不正确的是 ( )
| 选项 |
实验现象 |
解释 |
| A |
浓盐酸附近产生白烟 |
NH3与HCI反应产生了NH4CI固体 |
| B |
浓硫酸附近无白烟 |
NH3与浓硫酸不发生反应 |
| C |
干燥红色石蕊试纸不变色,湿润红色石蕊试纸变蓝 |
NH3与水反应生成了NH3.H2O,电离出OH一使红色石蕊试纸变蓝 |
| D |
氯化物溶液变浑浊 |
可能是AICI3与NH3反应生成AI(OH)3 |
某溶液中含有NH4+、H+、SO42-和OH-,对该溶液的描述一定正确的是 ( )
| A.该溶液可能呈酸性,也可能呈碱性或中性 |
| B.只能是硫酸铵和硫酸的混合溶液 |
| C.离子浓度由大到小的顺序是:c(NH4+)>c(SO42-)>c(H+)>e(OH一) |
| D.离子浓度存在下列关系:c(NH4+)+c(H+)=c(OH一)+c(SO42-) |
下列离子方程式书写正确的是 ( )
| A.氧化铁溶于氢碘酸:Fe2O3+6H+ |
|
| B.等物质的量的KHCO3和Ba(OH)2的溶液混合: HCO3-+Ba2++OH一 |
|
C.过氧化钠固体与水反应:2O22一+2H2O |
D.硫化钠水溶液呈碱性的原因:S2-+2H2O H2S↑T+2OH— |
在一密闭容器中充人4 mol SO2和一定量O2,发生反应:
 2SO2(g)+O2(g)2SO3(g)△H=一196.6 kJ·mol-1。
2SO2(g)+O2(g)2SO3(g)△H=一196.6 kJ·mol-1。
则下列说法正确的是 ( )
| A.为提高反应速率和SO2的转化率选择更高效的催化剂 |
| B.增大压强有利于SO2转化,平衡常数也会增大 |
| C.当放出353.6 kJ热量时,SO2的转化率接近90% |
| D.右图中纵坐标y为SO3的含量 |
用铜片、银片设计成如图所示的原电池。以下有关该原电池的叙述正确的是 ( )
| A.电子通过盐桥从乙池流向甲池 |
| B.铜导线替换盐桥,原电池仍继续工作 |
| C.开始时,银片上发生的反应是:Ag—e |
| D.将铜片浸入AgNO3溶液中发生的化学反应与该原电池总反应相同 |
以下是一些元素的信息,其中有一种元素不在短周期。根据信息完成问题:
| 元素A |
元素B |
元素C |
元素X |
元素Y |
元素Z |
| 单质是一种常见金属,与元素X形成黑色和砖红色两种化合物 |
单质是一种黄绿色气体 |
短周期中金属性最强,与X反应能生成两种化合物 |
最外层电子数是内层电子数的3倍,能形成双原子阴离子 |
单质为双原子分子,结构中 键与 键与 键数目比为1:2 键数目比为1:2 |
阳离子就是一个质子 |
(1)写出A元素基态原子的核外电子排布式 。
(2)B、C、X的简单离子半径由大到小的顺序为 (用元素离子符号表示)。
(3)化合物YZ4B化学键的类型是 ,检验该固体化合 物中阳离子的实验的方法和现象是 。
(4)A元素的单质在潮湿空气中锈蚀生成绿色物质,用一个化学方程式表示锈蚀过程 。
(5)常温下,工业上用惰性电极在电解槽中电解100 L 1.5mol·L-1CB的水溶液时,两极共收集到气体22.4L(标准状况下),计算电解后阴极区溶液的pH= (假设电解前后溶液体积不变)。
合成气(CO+H2)是一种重要的化工原料,在化工生产中具有十分广泛的用途。 可以生产被称为21世纪的新型燃料——甲醇、二甲醚(CH3OCH3)等物质。其工艺流程如下: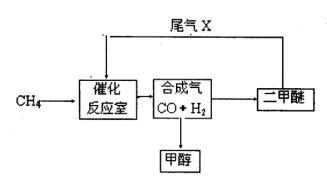
(1)写出用合成气生产二甲醚的化学方程式 。 (2)尾气循环中涉及到以下反应:CH4(g)+H2O(g) CO(g)+3H2(g),请写出某温度下该反应的平衡常数表达式 。
(2)尾气循环中涉及到以下反应:CH4(g)+H2O(g) CO(g)+3H2(g),请写出某温度下该反应的平衡常数表达式 。
(3)工业上一般采用下列两种反应合成甲醇: 反应Ⅰ: CO(g)+2H2(g) CH3OH(g)
反应Ⅰ: CO(g)+2H2(g) CH3OH(g) 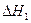
 反应Ⅱ:CO2(g)+3H2(g) CH3(g)+H2O(g)
反应Ⅱ:CO2(g)+3H2(g) CH3(g)+H2O(g)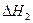
①下表所列数据是反应在不同温度下的化学平衡常数(K)。
| 温度 |
250 |
300 |
350 |
| K |
2.041 |
0.270 |
0.012 |
由表中数据判断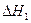 0(填“>”、“=”、“<”)。
0(填“>”、“=”、“<”)。
②已和:
CH3OH(g)+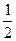 O2(g)
O2(g) CO2(g)+2H2(g)  =-192.9kJ·mol-1
=-192.9kJ·mol-1
H2(g)+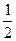 O2(g)
O2(g) H2O(g)  =-241.8kJ·mol-1
=-241.8kJ·mol-1
则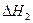 = 。
= 。
(4)以二甲醚、空气、氢氧化钾溶液为原料,铂为电极构成燃料电池。写出该电池负极的电极反应式 。
新型材料纳米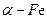 粉具有超强的磁性能,可用作高密度磁记录的介质以及高效催化剂等。在不同温度下,
粉具有超强的磁性能,可用作高密度磁记录的介质以及高效催化剂等。在不同温度下,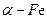 粉与水蒸气反应的固体产物不同:温度低于570℃时,生成FeO,高于570℃时,生成Fe3O4。某校化学小组学生利用下图所示装置进行“铁与水反应”的实验,并探究固体产物成分(图中夹持及尾气处理装置均已略去)。
粉与水蒸气反应的固体产物不同:温度低于570℃时,生成FeO,高于570℃时,生成Fe3O4。某校化学小组学生利用下图所示装置进行“铁与水反应”的实验,并探究固体产物成分(图中夹持及尾气处理装置均已略去)。
 |
(1)在高温下,装置B中发生反应的化学方程式是 。
(2)请在下列装置中选择满足虚线框图C的气体收集装置 。
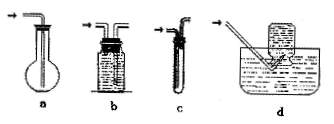 |
(3)该小组同学为探究实验结束后试管内的固体物质成分,进行了下列实验:
【查阅资料】该小组同学通过资料得知,固体产物中一般不会同时出现三种形态混合物组合。
【提出假设】
假设1:全部为氧化亚铁;
假设2:全部为四氧化三铁;
假设3:铁和氧化亚铁混合物;
假设4:铁和四氧化三儿混合物;
假设5: 。
【设计方案】小组成员讨论后对假设4提出实验方案(不要在答题卡上作答)
【实验过程】
根据上述设计的方案进行实验。在答题卡上按下表的格式写出实验步骤、预期现象与结论。
| 实验步骤 |
实验操作 |
实验现象 |
| Ⅰ |
将反应后得到黑色粉末X(假定为均匀的),取出少量放入另一试管中,加入适量盐酸,微热 |
黑色粉末全部溶解,溶液呈 ,有少量气泡产生 |
| Ⅱ |
向实验Ⅰ中得到的溶液加几滴KSCN溶液,振荡 |
溶液不显血红色 |
【交流讨论】①实验步骤Ⅱ加入 KSCN后溶液不显血红色的原因 。
②继续向Ⅱ溶液中加稀硝酸,立即出现血色,写出该过程中发生变化的
离子方程式 。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号