北京市东城区高三一模(理科综合)化学部分
下列叙述正确的是 ( )
| A.含有食品添加剂的食物都对人体有害 |
| B.SO2、NO2或CO2都会导致酸雨的形成 |
| C.玻璃、水泥的生产都要用石灰石做原料 |
| D.棉、毛及合成纤维完全燃烧都只生成CO2和H2O |
关于下列说法:①Fe(OH)3胶体和CuSO4溶液都是混合物;②BaSO4是一种难溶于水的强电解质;③冰醋酸、纯碱、小苏打分别属于酸、碱、盐;④太阳能、氢能和海洋能都属于新能源;⑤置换反应都属于离子反应。其中正确的是 ( )
| A.①②④ | B.①②⑤ | C.②③④ | D.③④⑤ |
下列叙述正确的是 ( )
| A.CH4O和C2H6O一定互为同系物 |
B.16g CH4与18 g NH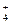 所含质子数相等 所含质子数相等 |
| C.32S与33S的核外电子数相等,是同一种核素 |
| D.质量相等、体积不等的N2和C2H4的分子数相等 |
有关右图所示原电池的叙述不正确的是 ( )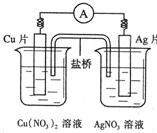
| A.电子沿导线由Cu片流向Ag片 |
| B.正极的电极反应是Ag++e-=Ag |
C.Cu片上发生氧化反应,Ag片 上发生还原反应 上发生还原反应 |
| D.用该电池电解饱和食盐水,3.2 g Cu溶解时生成1.12 L Cl2 |
关于下列各实验装置的叙述中,正确的是 ( )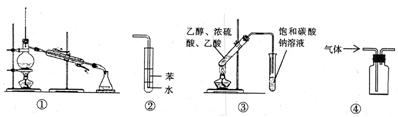
| A.装置①常用于分离互不相溶的液体 |
| B.装置②可用于吸收NH3 |
| C.装置③可用于制备乙酸乙酯 |
| D.装置④可用于收集NO、CO2等气体 |
在下列溶液中,各组离子一定能够大量共存的是( )
A.c(H+)=10-12mol·L-1的溶液:K+、Ba2+、C1-、NO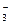 |
B.使酚酞变红的溶液:Na+、C1-、SO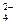 、Fe3+ 、Fe3+ |
C.使紫色石蕊变红的溶液:Fe2+、Mg2+、NO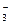 、C1- 、C1- |
D.碳酸氢钠溶液:K+、SO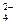 、C1-、H+ 、C1-、H+ |
室温下,下列叙述正确的是(溶液体积变化忽略不计) ( )
| |
① |
② |
③ |
④ |
||||
| 溶液 |
氨水 |
氢氧化钠溶液 |
醋酸 |
盐酸 |
||||
| pH |
11 |
11 |
3 |
3
|
短周期元素X、Y、Z、M、N原子序数依次增大,有关信息如下:
| 元素 |
有关信息 |
| X |
最外层电子数是次外层的2倍 |
| Y |
元素主要化合价为—2价 |
| Z |
其单质及化合物的焰色为黄色 |
| M |
与X同主族,其单质为半导体材料 |
| N |
 其单质在Y单质中燃烧,发出明亮的蓝紫色火焰 其单质在Y单质中燃烧,发出明亮的蓝紫色火焰 |
(1)XY2的电子式是 ;Z2Y2中所含化学键类型是 ;XY2与Z2Y2反应的化学方程式是 。
(2)恒容条件下,一定量的NY2、Y2发生反应:2NY2(g)+Y2(g) 2NY3(g)。温度分别为T1和T2时,NY3的体积分数随时间变化如右图,该反应的△H 0(填“>”“<”或“=”,下同);若T1、T2时刻反应的化学平衡常数分别为K1、K2,则K1 K2。
2NY3(g)。温度分别为T1和T2时,NY3的体积分数随时间变化如右图,该反应的△H 0(填“>”“<”或“=”,下同);若T1、T2时刻反应的化学平衡常数分别为K1、K2,则K1 K2。
(3)X的非金属性比M (填“强”或“弱”),能证明此结论的事实是 (用离子方程式表示)。
氮及其化合物与人们的生活息息相关。
(1)氮元素在周期表中的位置是 。
(2)实验室可用铜与稀硝酸反应制取NO,其离子方程式是 。为防止环境污染,可用碱液吸收氮的氧化物。NO与NO2按物质的量之比1:1被NaOH溶液完全吸收后得到一种钠盐,该钠盐的化学式是 。
(3)已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=—574kJ·mol-1②CH4(g)+4NO2(g)=2N2(g)+CO2(g)+2H2O(g)△H=—1160kJ·mol-1
根据①和②,标准状况下,4.48LCH4恰好将NO2转化为N2时,△H= 。
关于①和②,下列说法正确的是 (填字母)。
a. 由于反应①可推知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l)
△H<—574kJmol
b. 等物质的量的甲烷分别发生反应①、②,
转移电子数相同
c. 右图可表示①的反应过程和能量关系
(4)同温同压下,3.5LNH3恰好将3.0L NO和NO2的混合气完全转化为N2,原混和气中NO和NO2的体积比是  。
。
氯气是一种重要的化工原料。
(1)实验室可用二氧化锰和浓盐酸反应制取氯气,反应的化学方程式是 。
(2)资料显示:Ca(ClO)2+CaCl2+2H2SO4 2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
①在该实验中,甲部分的装置是 (填字母);
②乙装置中FeCl2溶液与Cl2反应的离子方程式是 。证明FeCl2与Cl2发生了氧化还原反应的实验方法是 ;
③丙装置中通入少量Cl2,可制得某种生活中常用的漂白、清毒的物质。已知碳酸的酸性强于次氯酸,则丙中反应的化学方程式是 ;
④该实验存在明显的缺陷,改进的方法是 。
(3)为测定漂白粉中Cs(ClO)2的质量分数,该小组将2.0g漂白粉配制成250mL溶液,取出25mL并向其中依次加入过量稀H2SO4、过量KI溶液,完全反应后,再滴入0.1mol·L-1Na2S2O3溶液:2Na2S2O3+I2=Na2S4O6+2NaI,共消耗20mLNa2S2O3溶液,则漂白粉中Ca(ClO)2的质量分数为 。
已知:
有机物A是一种医药中间体,质谱图显示其相对分子质量为130。已知0.5molA完全燃烧只生成3mol CO2和2.5molH2O。A可发生如下图所示的转化,其中D的分子式为C4H6O2,两分子F反应可生成六 元环状酯类化合物。
元环状酯类化合物。
请回答:
(1)1mol B与足量的金属钠反应产生22.4L(标准状况)H2。B中所含官能团的名称是
。B与C的相对分子质量之差为4,B→C的化学方程式是 。
(2)D的同分异构体G所含官能团与D相同,则G的结构简式可能是 、 。
(3)F可发生多种类型的反应。
①两分子F反应生成的六元环状酯类化合物的结构简式是 ;
②由F可生成使Br的CCl4溶液褪色的有机物H。F→H的化学方程式是 。
③F在一定条件下发生缩聚反应的化学方程式是 。
(4)A的结构简式是 。
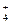 )> c (OH一)> c (H+)
)> c (OH一)> c (H+) 粤公网安备 44130202000953号
粤公网安备 44130202000953号