江苏省苏州市区九年级一模考试化学试卷
第53届世界乒乓球锦标赛即将在苏州举行,利用车厢创意广告和车身广告精心装扮的8 列“2015年苏州世乒赛专列”全部开行,吉祥物“乒宝”快乐的大头像随处可见。下列轻轨列车上的部件属于合成材料的是
| A.有机玻璃扶手 | B.玻璃窗 | C.金属栏杆 | D.玻璃钢座椅 |
磷酸二氢铵(NH4H2PO4)可增强农作物的抗旱能力。这种化肥属于
| A.钾肥 | B.磷肥 | C.氮肥 | D.复合肥 |
下列物质的应用中,利用其物理性质的是
| A.将铜打磨制成铜镜 | B.碘酒可用来检验淀粉 |
| C.氮气用作瓜果保护气 | D.石灰石分解制生石灰 |
将等体积的滴有红墨水的水和酒精分别缓缓注入如图所示的装置中,盖紧胶塞将两种液体混合,实验现象如图所示。从该实验中,能得到的结论是
| A.分子变小了 | B.分子间有空隙 |
| C.酒精不能溶于水 | D.不同分子间一定发生化学反应 |
下列有关水的说法中不正确的是
| A.水是一种最常用的溶剂 |
| B.鉴别软水和硬水可用肥皂水 |
| C.农药、化肥的不合理施用,会造成水体污染 |
| D.自然界中的水经过沉淀、过滤后可得到纯水 |
下列关于氧气的说法中正确的是
| A.氧气质量约占空气总质量的1/5 |
| B.氧气可以支持燃烧,说明氧气具有可燃性 |
| C.工业上用分离液态空气法制取氧气是分解反应 |
| D.氧气供给呼吸,它和体内物质反应,释放能量,维持生命活动 |
化学知识可以帮助我们远离灾害。以下做法不合理的是
| A.使用酒精灯时不慎打翻着火,用湿布盖灭 |
| B.厨房燃气管漏气,立即关闭阀门开窗通风 |
| C.实验时,把没有用完的白磷丢进垃圾筐里 |
| D.被困火场,用湿毛巾捂住口鼻,匍匐前进 |
AgNO3固体见光或受热易分解,故用棕色试剂瓶保存。AgNO3受热分解,放出的有刺激性气味的气体可能是
A. |
B. |
C. |
D. |
原子是构成物质的基本微粒。下列有关原子的叙述错误的是
| A.不是所有的原子中都含有中子 |
| B.原子的种类在化学变化中发生改变 |
| C.原子的质量主要集中在原子核上 |
| D.相同种类的原子可能构成不同的分子 |
下列有关钢铁的叙述不正确的是
| A.生铁和钢都属于合金 | B.在钢管表面镀锌可以防止锈蚀 |
| C.铁锈的结构疏松多孔 | D.铁丝在氧气中燃烧生成氧化铁 |
某化学兴趣小组的同学按下图操作完成粗盐(含有难溶性杂质)提纯的实验。下列说法中正确的是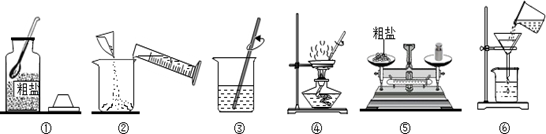
| A.各项实验操作完全正确 |
| B.正确的操作顺序为①⑤②③⑥④ |
| C.去除杂质的关键步骤是④ |
| D.操作③④中玻璃棒的作用是相同的 |
开发使用新能源是解决城市大气污染问题的根本途径。下列与新能源有关的说法中,错误的是
| A.使用氢燃料电池汽车,燃料电池系统将化学能转化为电能,是解决汽车尾气污染的有效措施 |
| B.晶体硅不仅是电子和信息工业的基础材料,也是研制太阳能电池的基础材料 |
| C.垃圾焚烧会产生对环境有害的物质,将烟囱建得高些,就可避免烟气产生的污染 |
| D.煤、石油通过炼制、加工,可制造各种有机合成材料、医药、农药、染料和炸药等 |
下列生活事实的解释中,不合理的是
| A.漂白粉可杀菌消毒,因其具有吸附性 |
| B.洗洁精可清除油污,因其具有乳化作用 |
| C.某合金可做保险丝,因该合金的熔点低 |
| D.氦气可填充气球,因其密度小和化学性质稳定 |
下列有关熟石灰的说法错误的是
| A.熟石灰的溶液俗称石灰水,呈碱性 |
| B.熟石灰可由生石灰与水反应而制得 |
| C.熟石灰的溶解度随温度的升高而增大 |
| D.熟石灰可以和硫酸铜溶液配制农药波尔多液 |
如图是某反应的微观示意图,下列说法错误的是
| A.该反应为置换反应 |
| B.生成物的分子个数比为1:1 |
| C.反应物中有单质 |
D.参加反应的 和 和 的质量比为17:24 的质量比为17:24 |
观察和实验是学习化学的重要方式,下列实验中观察到的颜色不正确的是
| A.硫粉在氧气中燃烧发出明亮的蓝紫色火焰 |
| B.加热碱式碳酸铜观察到固体由绿色变为黑色 |
| C.鸡蛋清溶液中加入几滴浓硝酸出现白色凝固物 |
| D.氢氧化钠溶液中滴加硫酸铜溶液生成蓝色沉淀 |
奥司他韦(C16H28N2O4)可抑制流感病毒在人体内的传播,起到治疗流行性感冒的作用。下列对奥司他韦的说法错误的是
| A.从分类角度看:属于有机物 |
| B.从量的角度看:氢元素的质量分数约为20.5% |
| C.从组成角度看:由碳、氢、氮、氧四种元素组成 |
| D.从结构角度看:分子中碳、氢、氮、氧原子个数比为8:14:1:2 |
下图是a、b、c三种物质的溶解度曲线。由图判断,下列说法中不正确的是
A.在 ℃时,a、b两溶液中溶质的质量分数相等 ℃时,a、b两溶液中溶质的质量分数相等 |
B.a的饱和溶液从 ℃降温至 ℃降温至 ℃时仍为饱和溶液 ℃时仍为饱和溶液 |
| C.a中混有少量b可采用降温结晶的方法进行提纯 |
D. ℃时,a的60g饱和溶液中含有溶剂质量50 g ℃时,a的60g饱和溶液中含有溶剂质量50 g |
除去下列物质中所含的少量杂质,方法正确的是
| |
物质 |
所含杂质 |
除杂质的方法 |
| A |
二氧化锰 |
氯化钠 |
加水溶解,过滤,蒸发结晶 |
| B |
氯化钠溶液 |
碳酸钠 |
加入过量稀盐酸,加热蒸发 |
| C |
氯化钙溶液 |
稀盐酸 |
加入过量氢氧化钙,过滤 |
| D |
氢氧化钠溶液 |
碳酸钠 |
加入适量石灰水 |
玻璃仪器常附着难清洗的物质,下列清洗方法不可行的是
| A.内壁有碘的试管用酒精清洗 |
| B.内壁有碳酸钙的试管用稀盐酸清洗 |
| C.内壁有植物油的试管用热纯碱溶液清洗 |
| D.内壁有氧化铁的试管用氢氧化钠溶液清洗 |
向 的混合溶液中加入一定质量的铁粉,反应完成后,过滤,下列情况不可能存在的是
的混合溶液中加入一定质量的铁粉,反应完成后,过滤,下列情况不可能存在的是
| A.滤纸上有Ag、Cu、Fe,滤液中有Zn2+、Fe2+ |
| B.滤纸上有Ag、Cu,滤液中有Zn2+、Fe2+ |
| C.滤纸上有Ag、Cu,滤液中有Cu2+、Zn2+、Fe2+ |
| D.滤纸上有Ag、Cu、Fe,滤液中有Cu2+、Zn2+、Fe2+ |
下列图像与对应选项关系合理的是
| A.向氯化钡和氢氧化钠的混合溶液中滴加稀硫酸 |
| B.用相同质量的氯酸钾固体加热分解来制取氧气 |
| C.向一定体积的氢氧化钠溶液中逐滴加入稀盐酸 |
| D.向一定质量一定质量分数的稀盐酸中加入铁粉 |
(3分)化学就在我们身边,它与我们的生活息息相关。现有
| A.金刚石; |
| B.烧碱; |
| C.盐酸; |
| D.二氧化硫; |
E.葡萄糖;
F.碳酸钾,
请用相应物质的化学式填空。
(1)人体胃液中含有的酸是 ;
(2)易吸水而潮解的碱是 ;
(3)草木灰的主要成分是 ;
(4)自然界中最坚硬的物质是 ;
(5)医学上称为“低血糖”的糖是 :
(6)能使高锰酸钾溶液褪色并引起酸雨的是 。
(8分)完成下列变化的化学方程式,并按要求填空。
(1)天然气燃烧: ,该反应 (填写“放热”或“吸热”);
(2)稀硫酸除铁锈: ,溶液由无色变为 ;
(3)工业上用赤铁矿炼铁的原理: ,冶炼生铁的主要设备是 ;
(4)若不慎将浓硫酸沾到皮肤或衣服上,应立即用大量的水冲洗,然后涂上3%~5% 的NaHCO3溶液: ;该反应的基本类型是 ;
(5)少量硫酸铵固体与熟石灰混合研磨: ;检验该气体可用 试纸。
(5分)氯化钠是重要的调味品,是舌尖上最不可缺少的味道。下面三幅示意图分别表示不同的化学反应,但生成物中都有氯化钠。
(1)图1是金属钠与氯气反应生成氯化钠的微观示意图,氯化钠由 构成(填微粒符号)。由图1可知,元素的化学性质与原子结构中的 (填字母序号)有密切的关系;
A.最外层电子数 B.内层电子数 C.质子数
(2)图2描述了NaOH溶液与盐酸反应的微观实质,图中A、B、C处应填入的化学符号依次为 ;
(3)图3所示的四种物质中属于氧化物的是 (填化学式),请标出NaClO2中氯元素的化合价 。
(9分)盐酸是重要的无机化工产品,广泛用于染料、医药、食品、冶金等行业。
(1)实验室使用的稀盐酸通常都是将浓盐酸用水稀释而成的。现欲用溶质质量分数为37%的浓盐酸配制14.6%的稀盐酸100g。步骤为:计算、 、稀释。量取水时应选用规格为 (从10、50、100中选取)rnL的量筒。最后将稀盐酸转移到试剂瓶中,贴上标签备用,在标签上可以不必注明的是 (填字母序号)。
A.100g B.14.6% C.稀盐酸
(2)若用上述所配稀盐酸(100g溶质质量分数为14.6%)制取氢气,理论上可制得氢气多少克?(写出具体计算过程,注意格式)
(3)该稀盐酸还可用来测定镀锌铁皮锌镀层的质量。将该铁皮与足量稀盐酸反应,待产生的气泡明显减少时取出(此时可认为锌己反应完全,铁还未参与反应),洗涤,烘干,称量,减少的质量即为锌镀层的质量。下列实验操作对测定结果的影响,判断不正确的是 (填字母序号)。
A.铁皮未及时取出,会导致测定结果偏小
B.铁皮未洗涤干净,会导致测定结果偏大
C.烘干时间过长,会导致测定结果偏小
D.把稀盐酸换成稀硫酸,会导致测定结果偏大
(4)取用上述所配稀盐酸25g与56g溶质质量分数为10%的氢氧化钾溶液相混合(含2滴酚酞试液),混合液刚好由红色变为无色,可认为恰好完全反应。将反应后所得溶液蒸发6.5g水(此过程中无晶体析出),求此时溶液的溶质质量分数。(写出具体计算过程,注意格式)
(9分)现有下列装置,回答问题:
(1)写出有标号仪器的名称:① ,② ;
(2)实验室用双氧水和二氧化锰制取氧气的化学方程式为 ,发生装置为 (填字母序号)。若反应过于剧烈,从实验安全角度考虑,可以采取的措施有 (写一种即可);
(3)实验室用高锰酸钾制取氧气,为进一步研究高锰酸钾的分解产物,某兴趣小组查阅资料,并取一定质量的高锰酸钾加热使之完全分解,进行下表所示的实验。
【实验内容】:
| 编号 |
实验内容 |
实验现象 |
实验结论 |
| 1 |
取反应后固体剩余物0.2g 加入5mL6%的  溶液 溶液 |
剧烈反应,放热 产生大量气泡 |
生成物中的 催化分解  |
| 2 |
取0.2g 加入5mL 加入5mL (  质量分数)的 质量分数)的 溶液 溶液 |
平稳反应,放热,持续产生气泡 |
 催化 催化分解  |
| 3 |
取反应后固体剩余物1.0g,加入足量水,充分溶解,过滤 |
固体完全溶解,滤纸 上无黑色固体残余物 |
固体剩余物中无 |
【实验分析】:
①完善上表中的填空内容:实验2 、实验3 ;
②实验2的目的是 ;
③经讨论,实验1的结论不正确,理由是 ;
【资料】:在43.9℃~377.9℃范围中, 受热分解时,会发生以下两个反应:
受热分解时,会发生以下两个反应:
④取8.0g ,加热使之完全分解,生成
,加热使之完全分解,生成 的质量可能为 (填字母序号);
的质量可能为 (填字母序号);
A.0.81g B.1.08g C.1.42g D.1.62g
⑤资料显示, 在43.9℃一377.9℃范围中的失重率(
在43.9℃一377.9℃范围中的失重率( 与
与 的质量比)为18.0%。结合资料分析,在43.9℃~377.9℃范围中,
的质量比)为18.0%。结合资料分析,在43.9℃~377.9℃范围中, 分解反应主要以 (填“a”或“b”)为主。
分解反应主要以 (填“a”或“b”)为主。
(6分)芬兰发明家马蒂·努尔米亚发明了一种中和处理二氧化碳的新方法,是将二氧化碳从火力发电厂的烟气中分离出来,放入含有长石成分的水溶液里进行中和处理。在反应过程中,长石的成分不仅能吸收二氧化碳,同时还会生成一些有用的副产品,这些副产品可用作生产铝的原材料和玻璃制造业。其主要流程可示意如下:
(1)发明家将CO2从火力发电厂的烟气中分离出来,通入含有长石的水溶液里吸收,从环保的角度看,这样做的意义是 ;
(2)长石是地壳中最常见的矿石,含量高达60%。长石主要包括钾长石 、钠长石
、钠长石 、钙长石(
、钙长石( )。若钙长石吸收
)。若钙长石吸收 的反应方程式为:
的反应方程式为:
请模仿钙长石,写出钠长石吸收CO2的化学反应方程式 ;
(3)若A的pH小于7,试写出一个符合反应②的化学方程式 ;
(4)溶液M中的溶质为 ,B可用作改良酸性土壤,则B为 _ ;操作③主要目的为 。









 粤公网安备 44130202000953号
粤公网安备 44130202000953号