高考原创化学预测卷 07(新课标II卷)
化学在生产和日常生活中有着重要的应用。下列叙述不正确的是
| A.Na2CO3俗称纯碱,可与盐酸反应,故可用于治疗人体内胃酸过多 |
| B.高温能杀死流感病毒是因为构成病毒的蛋白质受热变性 |
| C.农村施肥时,草木灰不能与铵态氮肥混用,以免氮肥肥效下降 |
| D.含有重金属的电器废品不能随意丢弃,要分类回收并利用 |
某有机物的结构简式如图所示,下列有关该物质的叙述错误的是

| A.该有机物能使酸性KMnO4溶液褪色 |
| B.该有机物苯环上的一氯代物有2种 |
| C.在一定条件下1mol该有机物可与4molH2发生反应 |
| D.该有机物分子中含有3种官能团 |
下列离子方程式中正确的是
| A.将SO2气体通入NaClO溶液中:SO2+2ClO-+H2O=SO32-+2HClO |
| B.铁和稀硝酸反应制得浅绿色溶液:Fe+ 4H+ + NO3- =Fe3+ + NO↑+ 2H2O |
| C.铝与NaOH溶液反应:2Al+2OH-+2H2O=2AlO2-+3H2↑ |
| D.NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-=NH3↑+H2O |
0.44 g铜镁合金完全溶解于100 mL密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体336 mL(标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到0.78 g沉淀。下列说法正确的是
| A.该合金中铜与镁的质量量之比是2∶1 |
| B.该浓硝酸中HNO3的物质的量浓度是7.0 mol/L |
| C.NO2和N2O4的混合气体中,NO2的体积分数是80% |
| D.得到0.78 g沉淀时,加入NaOH溶液的体积是1380mL |
下列根据实验操作和现象所得出的结论正确的是
| 选项 |
实验操作 |
实验现象 |
结 论 |
| A |
用湿润的淀粉碘化钾试纸检验气体X |
试纸变蓝 |
X为Cl2 |
| B |
向无色溶液中加盐酸酸化的BaCl2溶液 |
有白色沉淀 |
原溶液中定含SO42- |
| C |
取等物质的量的两种金属单质X、Y,分别与足量的盐酸反应 |
X产生氢气的体积比Y多 |
金属性:X>Y |
| D |
向加入了几滴酚酞试液的Na2CO3溶液中滴加BaCl2溶液 |
红色逐渐褪去 |
Na2CO3溶液中存在水解平衡 |
下列实验装置图合理的是
A.装置①所示装置可实现反应:Cu+2H2O Cu(OH)2+H2↑ Cu(OH)2+H2↑ |
| B.装置②验证FeCl3对H2O2分解反应有催化作用 |
| C.装置③可用于在实验室测定中和反应的反应热 |
| D.装置④能构成锌铜原电池 |
研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。CO可用于炼铁,已知:Fe2O3(s) + 3C(s)=2Fe(s) + 3CO(g) ΔH 1=+489.0 kJ·mol-1,
C(s) +CO2(g)=2CO(g) ΔH 2 =+172.5 kJ·mol-1 ;则CO还原Fe2O3(s)的热化学方程式为
| A.Fe2O3+ 3CO=2Fe+ 3CO2 △H=-28.5 kJ·mol-1 |
| B.Fe2O3(s)+ 3CO(g)=2Fe(s)+ 3CO2(g) △H=-28.5 kJ |
| C.Fe2O3(s)+ 3CO(g)=2Fe(s)+ 3CO2(g) △H= + 28.5 kJ·mol-1 |
| D.Fe2O3(s)+ 3CO(g)=2Fe(s)+ 3CO2(g) △H=-28.5 kJ·mol-1 |
含有硫元素的物质种类繁多。某学校兴趣小组对其中两类物质进行性质探究。
Ⅰ.已知可溶性硫化物在溶液中能与硫单质反应,生成可溶性的多硫化物(如Na2Sn)。
请回答下列问题:
(1)多硫化物Na2Sn溶于水的电离方程式为___________________________。
(2)在浓Na2S溶液中滴入少量氯水,经振荡,未发现沉淀物生成,其原因是(用离子方程式表示,下同)___________________________________________________。
(3)在足量氯水中,滴入少量Na2S溶液,经振荡,也未发现沉淀物生成,若再加入盐酸酸化的BaCl2溶液,即可产生白色沉淀,其原因是_____________________________。
Ⅱ.浓硫酸具有氧化性,不同浓度的硫酸氧化性不同。为了探究浓度对硫酸氧化性的影响,某学习小组进行了如下探究:称取无锈铁钉(碳素钢)12.0 g放入30.0 mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。为了测定气体Y中SO2的含量,设计如下三种方案:
方案①:取672 mL(标准状况)气体Y通入足量溴水中,然后加入足量BaCl2溶液,经适当操作后得干燥固体4.66 g。
方案②:向V mL c mol/L酸性高锰酸钾溶液中缓慢通入a L(标准状况)气体Y,溶液恰好完全褪色。
方案③:取V mL(标准状况)气体Y缓慢通入足量氢氧化钡溶液中,充分反应后,过滤、洗涤、烘干,称得固体质量为m g。
(1)其中不合理的是方案_____(填序号),理由是___________________________________。
分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含有少量的H2和CO2。为此设计了下列探究实验装置(夹持装置已略去)。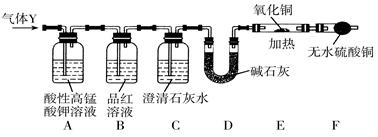
(2)装置A中试剂的作用是__________________________。
(3)简述确认气体Y中含有CO2的实验现象:________________________________。
(4)有同学根据“F干燥管中无水硫酸铜是否变蓝色”确 认气体Y中是否有氢气,你认为是否合理?______(填“合理”或“不合理”),简述理由:___________________________________。
(13分)运用化学反应原理研究氮、硫等单质及其化合物的反应有重要意义。
(1)硫酸生产过程中2SO2(g)+O2(g) 2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如图所示,根据如图回答下列问题:
2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如图所示,根据如图回答下列问题:
①2SO2(g)+O2(g) 2SO3(g)的ΔH________0(填“>”或“<”)。
2SO3(g)的ΔH________0(填“>”或“<”)。
②一定条件下,将SO2与O2以体积比为2∶1置于一体积不变的密闭容器中发生以下反应,能说明该反应已达到平衡的是________(填选项字母)。
a.体系的密度不发生变化
b.SO2与SO3的体积比保持不变
c.体系中硫元素的质量分数不再变化
d.单位时间内转移4 mol电子,同时消耗2 mol SO3
e.容器内的气体分子总数不再变化
(2)一定条件下,合成氨反应为:N2(g)+3H2(g) 2NH3(g)。图1表示在此反应过程中的能量变化,图2表示在2 L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)。图1表示在此反应过程中的能量变化,图2表示在2 L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
①该反应的平衡常数表达式为________,升高温度,平衡常数________(填“增大”“减小”或“不变”)。
②由图2信息,计算0-10 min内该反应的平均速率v(H2)________,从11 min起其他条件不变,压缩容器的体积为1 L,则n(N2)的变化曲线为________(填“a”“b”“c”或“d”)。
③图3 a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是________点,温度T1________T2(填“>”“=”或“<”)。
甲、乙两个研究性学习小组为测定氨分子中氮、氢原子个数比,设计了如下实验流程:

实验中,先用制得的氨气排尽洗气瓶前所有装置中的空气,再连接洗气瓶和气体收集装置,立即加热氧化铜。反应完成后,黑色的氧化铜转化为红色的铜。
下图A、B、C为甲、乙两小组制取氨气时可能用到的装置,D为盛有浓硫酸的洗气瓶。

甲小组测得:反应前氧化铜的质量m1 g、氧化铜反应后剩余固体的质量m2 g、生成氮气在标准状下的体积V1 L。
乙小组测得:洗气前装置D的质量m3 g、洗气后装置D的质量m4 g、生成氮气在标准状况下的体积V2 L。
请回答下列问题:
(1)写出仪器a的名称____________。
(2)检查A装置气密性的操作是_______________________________________。
(3)甲、乙两小组选择了不同的方法制取氨气,请将实验装置的字母编号和制备原理填写在下表的空格中。
| |
实验装置 |
实验药品 |
制备原理 |
| 甲小组 |
A |
氢氧化钙、硫酸铵 |
反应的化学方程式为 ①___________________________________________。 |
| 乙小组 |
__②__ |
浓氨水、氢氧化钠 |
用化学平衡原理分析氢氧化钠的作用③___________________________________________ |
(4)甲小组用所测数据计算出氨分子中氮、氢的原子个数之比为____________。
(5)乙小组用所测数据计算出氨分子中氮、氢的原子个数比明显小于理论值,其原因是__________。
为此,乙小组在原有实验的基础上增加了一个装有某药品的实验仪器,重新实验。根据实验前后该药品的质量变化及生成氮气的体积,得出了合理的实验结果。该药品的名称是____________。
[化学一选修2:化学与技术](15分)合成氨的流程示意图如下:
回答下列问题:
(1)工业合成氨的原料是氮气和氢气。氮气是从空气中分离出来的,通常使用的两种分离方法是________、________;氢气的来源是水和碳氢化合物,写出分别采用煤和天然气为原料制取氢气的化学反应方程式__________________________,______________________。
(2)设备A中含有电加热器、触媒和热交换器,设备A的名称是________,其中发生的化学反应方程式为___________;
(3)设备B的名称是________,其中m和n是两个通水口,入水口是________(填“m”或“n”)。不宜从相反方向通水的原因是______________________________;
(4)设备C的作用是_____________________________;
(5)在原料气制备过程中混有的CO对催化剂有毒害作用,欲除去原料气中的CO,可通过如下反应来实现:
CO(g)+H2O(g) CO2(g)+H2(g)。已知1 000 K时该反应的平衡常数K=0.627,若要使CO的转化率超过90%,则起始物中c(H2O)∶c(CO)不低于________。
CO2(g)+H2(g)。已知1 000 K时该反应的平衡常数K=0.627,若要使CO的转化率超过90%,则起始物中c(H2O)∶c(CO)不低于________。
[化学—选修3:物质结构与性质](15分)已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L电子层上有2对成对电子;E+原子核外有3层电子且各层均处于全满状态。
请填写下列空白。
(1)E元素基态原子的核外电子排布式为_________________。
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为_____________(填元素符号),其原因为_____________________。
(3)B元素的最高价氧化物对应的水化物中心原子采取的轨道杂化方式为 ,C元素的气态氢化物的VSEPR模型为 。B2A4是重要的基本石油化工原料,1 mol B2A4分子中含__________molσ键。
(4)B元素可形成多种单质,一种晶体结构如图一所示;另一种的晶胞如图二所示,该晶胞的空间利用率为 (保留两位有效数字)。( )
)

(5)向E的硫酸盐溶液中滴加过量氨水,观察到的现象是 。请写出上述过程的离子方程式 。
【化学——选修5:有机化学基础】聚氯乙烯(PVC)保鲜膜的安全问题引起广泛的关注。PVC的安全隐患主要来自于塑料中残留的PVC单体以及不符合国家标准的增塑剂DEHA。工业上用乙烯和氯气为原料经下列各步合成PVC:
(1)乙是PVC的单体,其结构简式为____________________________________________;
(2)反应③的化学方程式为____________________________________________________。
(3)写出以下反应类型:
反应①_______________________________________________________________________;
反应②_______________________________________________________________________。
(4)邻苯二甲酸辛酯(DOP)是国家标准中允许使用的增塑剂之一,邻苯二甲酸 是制造DOP的原料,它跟过量的甲醇反应能得到另一种增塑剂DMP(分子式为C10H10O4),DMP属于芳香酯,其结构简式为______________________。
是制造DOP的原料,它跟过量的甲醇反应能得到另一种增塑剂DMP(分子式为C10H10O4),DMP属于芳香酯,其结构简式为______________________。
(5)聚甲基丙烯酸羟乙酯的结构简式为: ,它是制作软质隐形眼镜的材料。请写出下列有关反应的化学方程式:
,它是制作软质隐形眼镜的材料。请写出下列有关反应的化学方程式:
①由甲基丙烯酸羟乙酯制备聚甲基丙烯酸羟乙酯______________________;
②由甲基丙烯酸制备甲基丙烯酸羟乙酯______________________________;
③由乙烯制备乙二醇_________________________________。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号