高考原创化学预测卷 02(新课标II卷)
化学与生产、生活密切相关。下列说法正确的是
| A.对“地沟油”进行分馏可以获得汽油发动机的燃料 |
| B.淀粉、纤维素和蛋白质都属于有机高分子化合物 |
| C.从海水中提取物质解决资源短缺问题,都必须通过化学反应才能实现 |
| D.工业上以氯气和澄清石灰水为原料制造漂白粉 |
近期在一些地区爆发的埃博拉疫情呈加速蔓延之势,已知该病毒对化学药品敏感,使用酒精、84消毒液等均可以达到消毒的目的,下列关于说法中正确的是
| A.使用酒精、84消毒液进行消毒的化学原理相同,都是利用了它们的氧化性杀死病毒的 |
| B.84消毒液的主要成分为次氯酸钠,可以通过氯气与NaOH溶液反应得到 |
| C.酒精可以通过淀粉发酵的方法获得,其中淀粉和纤维素化学式均为(C6H10O5)n,二者属于同分异构体 |
| D.乙烯在一定条件下也可得到乙醇,该反应的类型为取代反应 |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.加入KSCN溶液变红色的溶液:NH4+、K+、I-、SO42- |
| B.在pH=11的溶液中:Na+、AlO2-、NO3-、S2-、SO32- |
| C.由水电离的c(OH-)=10-13mol·L-1的溶液中:Na+、Cl-、HCO3-、NO3- |
| D.使甲基橙变红色的溶液:Fe2+、K+、SO42-、NO3- |
已知Fe3+、Fe2+、NO3-、NH4+、H+和H2O六种微粒属于一个氧化还原反应中的反应物和生成物。下列叙述中不正确的是
| A.还原产物为NH4+ |
| B.氧化剂与还原剂的物质的量之比为1∶8 |
| C.Fe3+和Fe2+分别属于反应物和生成物 |
| D.若把该反应设计为原电池,则负极反应为Fe2+-e- = Fe3+ |
元素周期表和元素周期律可以指导人们进行规律性的推测和判断。下列推测或判断不合理的是
| A.若X+和Y2-的核外电子层结构相同,则原子序数:X > Y |
| B.由水溶液的酸性:HCl>H2S,可知元素的非金属性:Cl>S |
| C.因硅、锗位于金属与非金属的交界处,故都可以做半导体材料 |
| D.Cs和Ba分别位于第六周期IA和IIA,故碱性:CsOH >Ba(OH)2 |
根据下表提供的数据,下列判断正确的是
A.等物质的量的Na2CO3和CH3COOH两种溶液混合,一定有: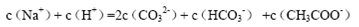 |
B.常温下,已知酸H2A存在如下平衡: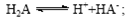 ; ;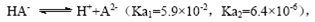 ,则NaHA溶液中水的电离程度一定大于纯水中水的电离程度 ,则NaHA溶液中水的电离程度一定大于纯水中水的电离程度 |
| C.相同浓度的CH3COONa和NaClO混合溶液中各离子浓度大小关系是:c(Na+)> c(ClO-)> c(CH3COO-)> c(OH-)>c(H+) |
| D.常温下,在0.1mol/LCH3COOH溶液中滴加0.1mol/LNaOH的溶液发生反应,当c(CH3COOH):c(CH3COO-)=5:9时,此时溶液pH=5 |
已知:
①2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
②2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1
③H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1
下列说法正确的是
| A.由①知H2(g)的燃烧热为△H="-571.6" kJ·mol-1 |
| B.由①②可知同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多 |
| C.反应③为中和反应的反应热,由此可知含1 mo1 CH3COOH的溶液与含1 mol NaOH的溶液混合,放出热量为57.3 kJ |
| D.利用盖斯定律可得:3H2(g)+CO2(g)=CH3OH(l)+H2O(l) ΔH=+135.9 kJ·mol-1 |
I.甲、乙、丙、丁四种物质存在转化关系:

(1)若甲、乙均为空气主要成分,则丁与水反应的化学方程式为 。
(2)若甲为常见的固体非金属单质,丙可使品红溶液褪色,则丁为____________。
(3)若乙是生活常见金属单质,丙→丁的离子方程式为 。
(4)若丙既能与强酸又能与强碱反应,则丙的化学式为 (任写1种)。
II.一定温度下,容积为1 L的密闭容器中投入0.5 mol PCl5(g),存在平衡:PCl5(g) PCl3(g)+ Cl2(g)。反应过程中测得部分数据如下表:
PCl3(g)+ Cl2(g)。反应过程中测得部分数据如下表:
| 时间 |
n(PCl5)/mol |
n(PCl3)/mol |
n(Cl2)/mol |
| 0 |
0.5 |
0 |
0 |
| t1 |
0.45 |
|
|
| t2 |
|
0.1 |
|
| t3 |
0.4 |
|
|
(5)t1时刻,测得反应吸收的热量为a kJ。PCl3(g)与Cl2(g)反应的热化学反应方程式为 。
(6)t2时:v正 v逆(填“>”、“<”或“=”)。
(7)计算该反应的化学平衡常数K=_____________。相同温度下,改为往容器中投入0.2 mol PCl5(g)、0.2 mol PCl3(g)、0.1 mol Cl2(g),到达平衡前,PCl5的物质的量将 (填“增大”、“减小”、“不变”)。
CuCl2常用于颜料、木材防腐等工业,并用作消毒剂、媒染剂、催化剂。工业上用粗制的氧化铜粉末(含杂质FeO和SiO2)来制取无水CuCl2的流程如下:
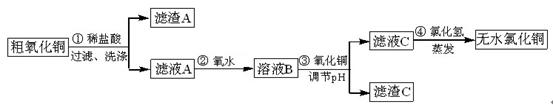
已知:Fe3+、Fe2+、Cu2+ 转化为相应的氢氧化物,开始沉淀和沉淀完全时的pH如下表:
| 离子符号 |
Fe3+ |
Fe2+ |
Cu2+ |
| 氢氧化物开始沉淀时的pH |
2.5 |
7.0 |
4.7 |
| 氢氧化物完全沉淀时的pH |
3.2 |
9.7 |
6.7 |
(1)第②步反应的离子方程式为 。
(2)滤渣A的成分有 (填化学式),检验滤液C中的Fe3+ 离子是否除尽的方法是 。
(3)第④步蒸发操作必要的仪器有铁架台(含铁圈)、坩埚钳、石棉网、 。需要在氯化氢气流中蒸干制取无水氯化铜的原因是 。
(4)称取30.250g已制得的无水CuCl2产品(含少量FeCl3杂质),溶于水中,加入过量的铁粉充分反应后过滤,得250mL滤液,量取25.00mL滤液于锥形瓶中,用0.100mol∙L-1酸性KMnO4溶液滴定至终点,消耗KMnO4溶液体积平均为46.00mL,则该无水CuCl2产品中CuCl2的质量分数为 (用小数表示,计算结果保留2位小数)。
氯化铁是常见的水处理剂,工业上制备无水FeCl3的一种工艺如下:

(1)试写出吸收塔中吸收剂Q(FeCl2)反应的离子方程式: 。
(2)取0.5mL三氯化铁溶液滴入50mL沸水中,再煮沸片刻得红褐色透明液体,该过程可用离子方程式表示为___________________________________。
(3)六水合氯化铁在水中的溶解度如下:
| 温度/℃ |
0 |
10 |
20 |
30 |
50 |
80 |
100 |
| 溶解度(g/100gH2O) |
74.4 |
81.9 |
91.8 |
106.8 |
315.1 |
525.8 |
535.7 |
从FeCl3溶液制得FeCl3·6H2O晶体的操作步骤是:加入少量盐酸、 、 、过滤、洗涤、干燥。
(4)常温下,若溶液的pH控制不当会使Fe3+沉淀,pH=4时,溶液中c(Fe3+)= mol·L-1。(常温下Ksp[Fe(OH)3]=2.6×10-39)。
(5)FeCl3的质量分数通常可用碘量法测定:称取mg无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入淀粉指示剂并用c mol·L―1 Na2S2O3溶液滴定用去V mL。
(已知:I2+2S2O32-=2I-+S4O62-))
①滴定终点的现象是: 。
②样品中氯化铁的质量分数为 (用字母m、c、V来表示)。
(6)用FeCl3溶液(32%~35%)腐蚀印刷线路板的废液中含FeCl3、FeCl2和CuCl2。
①若用电化学方法使废液再生。
阳极反应为:2Fe2+– 2e-= 2Fe3+
阴极反应为:___________________
②若用化学方法,回收废液中铜的方法是(用反应式表示并简述操作要点):______________
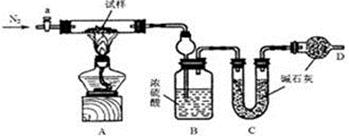
【化学—选修2:化学与技术】(15分)将海水淡化与浓海水资源化结合起来是综合利用海水的重要途径之一。一般是先将海水淡化获得淡水,再从剩余的浓海水中通过一系列工艺提取其他产品。
回答下列问题:
(1)下列改进和优化海水综合利用工艺的设想和做法可行的是 (填序号)。
①用混凝法获取淡水 ②提高部分产品的质量
③优化提取产品的品种 ④改进钾、溴、镁的提取工艺
(2)采用“空气吹出法”从浓海水中吹出Br2,并用纯碱吸收。碱吸收溴的主要反应是Br2+Na2CO3+H2O→NaBr + NaBrO3+NaHCO3,吸收1mol Br2时,转移的电子数为 mol。
(3)海水提镁的一段工艺流程如下图:
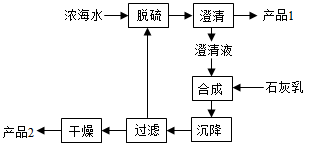
浓海水的主要成分如下:
| 离子 |
Na+ |
Mg2+ |
Cl- |
SO42- |
| 浓度/g/L |
63.7 |
28.8 |
144.6 |
46.4 |
该工艺过程中,脱硫阶段主要反应的离子方程式为 ,产品2的化学式为 ,1L浓海水最多可得到产品2的质量为 g。
(4)采用石墨阳极、不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式为 ;电解时,若有少量水存在会造成产品镁的消耗,写出有关反应的化学方程式 。
【化学——选修3:物质结构与性质】目前半导体生产展开了一场“铜芯片”革命——在硅芯片上用铜代替铝布线,古老的金属铜在现代科技应用上取得了突破,用黄铜矿(主要成分为CuFeS2)生产粗铜,其反应原理如下:
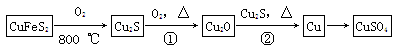
(1)基态铜原子的外围电子层排布为________,硫、氧元素相比,第一电离能较大的元素是________(填元素符号)。
(2)反应①、②中均生成有相同的气体分子,该分子的中心原子杂化类型是________,其立体结构是______________。
(3)某学生用硫酸铜溶液与氨水做了一组实验:CuSO4溶液 蓝色沉淀
蓝色沉淀 沉淀溶解,得到深蓝色透明溶液。写出蓝色沉淀溶于氨水的离子方程式_______________________;深蓝色透明溶液中的阳离子内存在的化学键类型有 。
沉淀溶解,得到深蓝色透明溶液。写出蓝色沉淀溶于氨水的离子方程式_______________________;深蓝色透明溶液中的阳离子内存在的化学键类型有 。
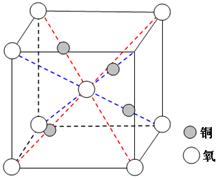
(4)铜是第四周期最重要的过渡元素之一,其单质及化合物具有广泛用途,铜晶体中铜原子堆积模型为_____________;铜的某种氧化物晶胞结构如图所示,若该晶体的密度为d g/cm3,阿伏加德罗常数的值为NA,则该晶胞中铜原子与氧原子之间的距离为________cm。((用含d和NA的式子表示)。

 粤公网安备 44130202000953号
粤公网安备 44130202000953号