高考原创化学预测卷 06(新课标I卷)
下列说法正确的是
| A.科学家在宇宙深处发现了H3+与H3,二者互为同位素 |
| B.煤的液化是先进的煤炭转化技术之一,其处理过程中只发生物理变化 |
C.N2的结构式为N N,电子式为 N,电子式为 |
| D.往沸水中滴加饱和氯化铁溶液后,稍加煮沸制备氢氧化铁胶体,不宜长时间加热 |
X、Y、Z、M是元素周期表中前20号元素,其原子序数依次增大,且X、Y、Z相邻,X的核电荷数是Y的核外电子数的一半,Y与M可形成化合物M2Y.下列说法 正确的是
| A.还原性:X的氢化物>Y的氢化物>Z的氢化物 |
| B.简单离子的半径:M的离子>Z的离子>Y的离子>X的离子 |
| C.YX2、M2Y都含有极性共价键 |
| D.Z元素的最高价氧化物的水化物的化学式为HZO4 |
N2H4(肼)常用作火箭升空所需的高能燃料,用N2O4作助燃剂,下列说法正确的是
| A.理论上要使产物污染最小,氧化剂与还原剂的物质的量比为2:1 |
| B.标准状况下,22.4L的N2O4气体中分子的数目为NA(NA表示阿佛加德罗常数) |
| C.N2H4分子中即有极性键又有非极性键 |
| D.N2O4与N2H4发生的化学反应不能设计成原电池 |
某有机物结构简式如图,下列说法不正确的是
| A.分子式为C10H11ClO3 |
| B.分子中含有3种官能团 |
| C.分子中只有酯基可与NaOH溶液反应 |
| D.可与金属Na反应置换出氢气 |
下列有关溶液组成的描述合理的是
| A.[Al(OH)4]-与HCO3-在溶液中不能大量共存是因为二者可发生双水解反应 |
| B.酸性溶液中可能大量存在、Cl‾、SO42‾、 |
| C.HCO3‾即不能在酸性溶液中存在,也不能在碱性溶液中存在 |
| D.FeCl3溶液中可能存在:c(H+)=c(OH‾) |
常见的无机酸25℃时在水溶液中的电离平衡常数如下表
| 无机酸 |
氢氰酸(HCN) |
碳酸(H2CO3) |
氢氟酸(HF) |
| 电离平衡常数K值 |
6.2×10—10(K) |
4.2×10—7(K1) 5.6×10—11(K2) |
6.61×10—4(K) |
下列选项正确的是
A.氟化钠溶液中通入过量CO2:F—+H2O+CO2=HF+HCO3—
B.Na2CO3溶液中:2c(Na+)=c(CO32—)+c(HCO3—)+c(H2CO3)
C.中和等体积、等pH的氢氰酸(HCN)和氢氟酸(HF)消耗NaOH的量前者大于后者
D.等浓度的NaCN和NaF溶液中pH值前者小于后者
(16分)合理的处理C与N的化合物,减少对环境产生污染,是科学家研究的课题。
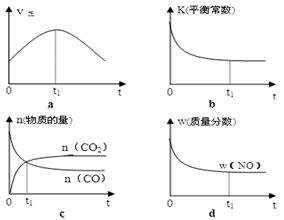
(1)汽车尾气净化的主要原理为:2NO(g) + 2CO(g) 2CO2(g)+ N2(g) △H<0若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。
2CO2(g)+ N2(g) △H<0若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。
(2)在一定条件下,CH4和CO2以镍合金为催化剂,发生反应:CO2(g)+CH4(g) 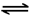 2CO(g)+2H2(g),其平衡常数为K,在不同温度下,K 的值如下:
2CO(g)+2H2(g),其平衡常数为K,在不同温度下,K 的值如下:

①从上表可以推断:该反应的逆反应是 (填“吸”、“放”)热反应。
②同一条件下该反应正反应的平衡常数为K1,逆反应的表达式平衡常数为K2,K1与K2的关系式 。
(3)煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol
2NO2(g)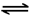 N2O4(g) △H=-56.9 kJ/mol
N2O4(g) △H=-56.9 kJ/mol
H2O(g) = H2O(l) △H=-44.0 kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式: 。
(4)在一定条件下,可以用NH3处理NOx。已知NO与NH3发生反应生成N2和H2O,现有NO和NH3的混合物1mol,充分反应后得到的还原产物比氧化产物多1.4 g,则原反应混合物中NO的物质的量可能是_____________。
(5)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是_________。
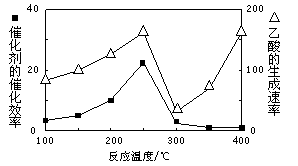
②为了提高该反应中CH4的转化率,可以采取的措施是 。
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为 。
实验室从含碘废液(除H2O外,含有CCl4、I2、I-等)中回收碘,其实验过程如下:
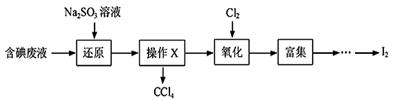
(1)向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为 ;该操作将I2还原为I-的目的是 。
(2)操作X的名称为 。
(3)氧化时,在三颈瓶中将含I-的水溶液用盐酸调至pH约为2,缓慢通入Cl2,在400C左右反应(实验装置如图所示)。实验控制在较低温度下进行的原因是 ;锥形瓶里盛放的溶液为 。

(4)利用下图所示装置(电极均为惰性电极)也可吸收SO2,并用阴极排出的溶液吸收NO2。
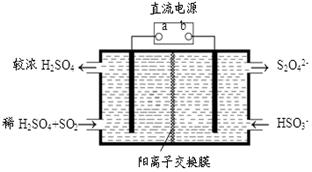
①a为电源的 (填“正极”或“负极”),阳极的电极反应式为 。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成。该反应离子反应方程式为: ,中氧化剂与还原剂的物质的量之比为 。
亚硝酸钠(NaNO2)是一种常见的食品添加剂,使用时必须严格控制其用量,某兴趣小组进行下面实验探究,查阅资料知道:
①2NO + Na2O2 = 2NaNO2
②2NO2 + Na2O2 = 2NaNO3
③酸性KMnO4溶液可将NO2-氧化为NO3-,MnO4-还原成Mn2+。
Ⅰ.产品制备与检验:用如下装置制备NaNO2:

(1)写出装置A烧瓶中发生反应的化学方程式 。
(2)B装置的作用是 。
(3)有同学认为装置C中产物不仅有亚硝酸钠,还有 ,为制备纯净NaNO2作以下改进: 。
(4)试设计实验检验装置C中NaNO2的存在(写出操作、现象和结论) 。
Ⅱ.含量的测定
称取装置C中反应后的固体4.000g溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol/L酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
| 滴定次数 |
1 |
2 |
3 |
4 |
| KMnO4溶液体积/mL |
20.60 |
20.02 |
20.00 |
19.98 |
(5)第一组实验数据出现异常,造成这种异常的原因可能是 (双项选择)。
A.酸式滴定管用蒸馏水洗净后未用标准液润洗
B.锥形瓶洗净后未干燥
C.滴定终了仰视读数
D.滴定终了俯视读数
(6)根据表中数据,计算所得固体中亚硝酸钠的质量分数 (结果保留4位有效数字)。
[化学——选修3:物质结构与性质]W、Q、R、X、Y、Z六种元素的原子序数逐渐增大。已知W原子1s轨道上只有一个电子,Q、X原子p轨道的电子数分别为2和4,Z的原子序数为29,除Z外均为短周期主族元素,Y原子的价电子排布为(n+1)sn(n+1)pn。请回答下列问题:
(1)Q和W能形成一种化合物的相对分子质量为28,则该化合物的中心原子采取的杂化轨道类型是 ,该分子中含有____个 键。
键。
(2)Z原子的核外电子排布式为 ;向Z的硫酸盐中逐滴加入氨水先产生沉淀,后沉淀溶解为深蓝色溶液,加入乙醇会析出蓝色晶体,该晶体中Z的离子与NH3之间的化学键为 。
(3)这六种元素中,电负性最大与最小的两种非金属元素形成的晶体属于____晶体;W、Q、X三种元素之间可以形成多种化合物,其中邻羟基苯甲醛的沸点低于对羟基苯甲醛的沸点,理由是 。邻甲基苯甲醛分子中碳原子轨道的杂化类型为 。1 mol 苯甲醛分子中σ键为 mol。
(4)元素X的阴离子Xn-中所有电子正好充满K和L电子层,CnX晶体的最小结构单元如图所示。

该晶体中阳离子和阴离子个数比为____,晶体中每个Xn-被 个等距离的C+离子包围。
[化学——选修5:有机化学基础]有机高分子化合物甲是一种常用的光敏高分子材料,其结构简式为: 。
。
按图可以合成甲,其中试剂Ⅰ可由相对分子质量为26的烃与水加成制得。

已知:
①-CH2OH + -CH2OH 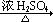 -CH2OCH2- + H2O
-CH2OCH2- + H2O
②
回答下列问题:
(1)试剂Ⅰ的名称是 ;B→C的反应类型是 ;
(2)质谱图显示A的相对分子质量是80.5;A分子中氧元素的质量分数为19.88%,碳元素的质量分数为29.81%,其余为氢元素和氯元素,且A的核磁共振氢谱上有三个吸收峰,峰面积的比例为2:2:1,则A的结构简式为 。
(3)写出下列反应的化学方程式。
①D→E的反应 ;
②C与F的反应 。
(4)E的一种同分异构体,水解产物有两种,一种能使溴水褪色,另一种在滴加饱和溴水后,有白色沉淀生成,该物质的结构简式为 。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号