高考原创化学预测卷 05(山东卷)
下列说法正确的是
| A.把CuSO4溶液加入到鸡蛋白溶液中出现浑浊,是因为发生了蛋白质溶液的盐析 |
| B.二氧化硅能制造光缆,也可用于制造太阳能电池 |
| C.煤的燃烧、工业废气、建筑扬尘、垃圾焚烧等都是造成雾霾天气的主要原因 |
| D.18.0g重水(D2O)与标准状况下22.4LNe所含有的电子数相等 |
短周期元素X、Y、Z、W 的原子序数依次增大,且原子最外层电子数之和为13。X 的原子半径比Y 的小,X 与W 同主族,Z 是地壳中含量最高的元素。下列说法不正确的是
| A.原子半径的大小顺序: r(W)>r(Y)>r(Z)>r(X) |
| B.元素Z、W 的简单离子的电子层结构相同 |
| C.元素Y 的简单气态氢化物的热稳定性比Z 的强 |
| D.只含X、Y、Z 三种元素的化合物,可能是离子化合物,也可能是共价化合物 |
柠檬烯是一种食用香料,其结构简式如图,有关柠檬烯的分析正确的是
| A.柠檬烯的分子式是C10H12 |
| B.柠檬烯和丁基苯互为同分异构体 |
| C.柠檬烯的一氯代物有4种 |
| D.在一定条件下,柠檬烯可以发生加成、取代、氧化、还原等反应 |
如图装置,将溶液A逐滴加入固体B中,下列叙述中不正确的是
| A.若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液不褪色 |
| B.若A为醋酸溶液,B为贝壳,C中盛过量澄清石灰水,则C中溶液变浑浊 |
| C.若A为浓硫酸,B为Na2SO3固体,C中盛石蕊溶液,则C中溶液先变红后褪色 |
| D.若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中产生白色沉淀 |
下列有关离子反应的表达或描述正确的是
| A.H218O中投入Na2O2固体,离子方程式为:2H218O + 2Na2O2 = 4Na+ + 4OH- + 18O2↑ |
| B.等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合,离子方程式为:Ba2++2OH-+NH4++HCO3-= BaCO3↓+NH3·H2O+H2O |
| C.若溶液中由水电离产生的c(OH-)=1×10-12mol/L,则K+、I-、NO3-、Cl-一定能大量共存 |
| D.向某溶液中滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口,试纸不变蓝,说明原溶液不含NH4+ |
制备食用碘盐(KIO3)原理之一为:I2+2KClO3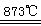 Cl2+2KIO3,下列说法正确的是
Cl2+2KIO3,下列说法正确的是
| A.向KClO3溶液中滴加AgNO3溶液得到白色AgCl沉淀 |
| B.反应过程中I2置换出Cl2,由此可推断非金属性I>CI |
| C.KClO3和KIO3均属于离子化合物,都只含有离子键 |
| D.制备KIO3的反应中氯元素被还原 |
下列叙述正确的是
| A.向100mL0.1mol/L 的溴化亚铁溶液中通入0.05mol的氯气时发生反应的离子方程式:2Fe2++4Br-+3Cl2="2" Fe3++2Br2+6Cl- |
| B.能溶解Al(OH)3的溶液中,Fe3+、Na+、Cl‾、ClO‾一定能大量共存 |
| C.常温下,将pH=2的H2SO4溶液与pH=12的氨水等体积混合,反应后溶液呈酸性 |
| D.pH相等的CH3COONa、Na2CO3、Na2SO3、KOH溶液,溶质物质的量浓度由大到小的顺序为:KOH> Na2CO3>CH3COONa> Na2SO3 |
对含氮物质的研究和利用有着极为重要的意义。
(1)N2、O2和H2相互之间可以发生化合反应,已知反应的热化学方程式如下:
N2(g)+O2(g)=2NO(g) 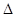 H=+180.5kJ·mol-1;
H=+180.5kJ·mol-1;
2H2(g)+O2(g)=2H2O(g) 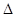 H =-483.6 kJ·mol-1;
H =-483.6 kJ·mol-1;
N2(g)+3H2(g)=2NH3(g) 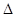 H =-92.4 kJ·mol-1。
H =-92.4 kJ·mol-1。
H2O(g) = H2O(l) ΔH =-44.0 kJ/mol
则氨的催化氧化反应生成液体水的热化学方程式为 。
(2)汽车尾气净化的一个反应原理为:2NO(g)+2CO(g)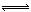 N2(g)+2CO2(g)
N2(g)+2CO2(g)  H<0。
H<0。
一定温度下,将2.8mol NO、2.4mol CO通入固定容积为2L的密闭容器中,反应过程中部分物质的物质的量变化如图所示。
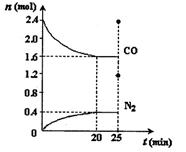
①增大压强,NO的平衡转化率 (填“增大”、“减小”、“不变”),0~20min平均反应速率v(NO)为 。25min时,若保持反应温度不变,再向容器中充入NO、CO2各1.2 mol,则化学平衡将 移动(填“向左”、“向右”或“不”)。
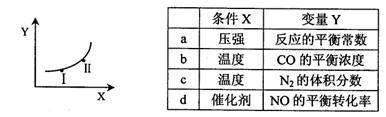
②若只改变某一反应条件X,反应由原平衡I达到新平衡II,变量Y的变化趋势如下图所示。下列说法正确的是 (填字母代号)。
(3)某化学小组拟设计以N2和H2为电极反应物,以HCl—NH4Cl为电解质溶液制成燃料电池,则该电池的正极反应式为 。假设电解质溶液的体积不变,下列说法正确的是 (填字母代号)。
a.放电过程中,需要向燃料电池中补充H+
b.溶液中的NH4Cl浓度增大, 所以Cl-离子浓度也增大
c.每转移6.02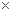 1023个电子,则有标准状况下11.2L电极反应物被氧化
1023个电子,则有标准状况下11.2L电极反应物被氧化
d.为保持放电效果,电池使用一段时间需更换电解质溶液
(18分)NOx、SO2是主要的大气污染物,科学处理这些污染物对改善人们的生存环境具有重要的现实意义。
(1)利用甲烷催化还原氮氧化物。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJ•mol-1
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g);△H=-867kJ•mol-1
则CH4与NO反应生成N2与CO2的热化学方程式为:______________________________________。
(2)利用氧化氮氧化物的流程如下: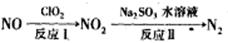
写出反应Ⅱ的化学方程式 ________________;已知反应I的化学方程式为2NO+ClO2+H2O=NO2+HNO3+HCl,若反应Ⅱ中生成N2的体积(标准状况下)为2.24L,则反应I中转移电子的物质的量为_________,还原剂的质量为_________。
(3)常温下,用NaOH溶液吸收SO2得到pH=9的Na2SO3溶液,吸收过程中水电离出的OH‾浓度_________(填“增大”、“减小”或“不变”);试计算溶液中 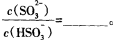 。
。
(常温下H2SO3的电离常数: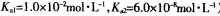 )
)
(4)利用Fe2(SO4)3溶液也可处理SO2废气,其流程如下图所示。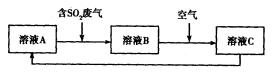
①简述用Fe2(SO4)3晶体配制溶液A的方法__________________。
②写出向溶液A中通入含SO2废气反应的离子方程式______________________________。
③设计实验验证溶液B是否仍具有处理废气的能力,简述实验的操作、现象和结论________________。
工业上从电解精炼铜的阳极泥(含金、银、铜、硒等单质)中提取硒的湿法工艺流程如下:
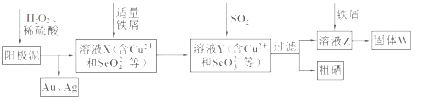
(1)向溶液X中加入铁屑的作用是______ ,此操作中不能加入过量铁粉的原因是______。
(2)检验溶液Z中阴离子的操作方法是______。
(3)过滤操作中要用到玻璃棒,请另举两例用到玻璃棒的实验或操作:______。
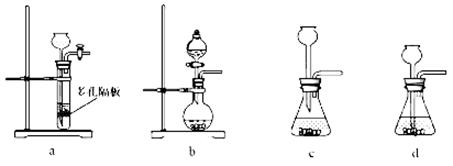
(4)实验室中制取SO2的原理为: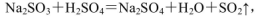 ,此处应使用______(填“较浓的硫酸”或“稀硫酸”),原因是______。制取SO2的装置,最好选用下图中的______。
,此处应使用______(填“较浓的硫酸”或“稀硫酸”),原因是______。制取SO2的装置,最好选用下图中的______。
(5)粗硒中硒的含量可用如下方法测定: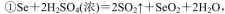
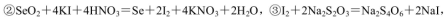 通过用Na2S2O3标准溶液(显碱性)滴定反应②中生成的I2来计算硒的含量。滴定操作中用到的玻璃仪器有_______。实验中准确称量0.1200g粗硒样品,滴定中消耗0.2000mol
通过用Na2S2O3标准溶液(显碱性)滴定反应②中生成的I2来计算硒的含量。滴定操作中用到的玻璃仪器有_______。实验中准确称量0.1200g粗硒样品,滴定中消耗0.2000mol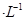 的Na2S2O3溶液27.60mL,则粗硒样品中硒的质量分数为 。
的Na2S2O3溶液27.60mL,则粗硒样品中硒的质量分数为 。
【化学与技术】海洋是一个巨大的化学资源宝库,下图是海水加工的示意图:
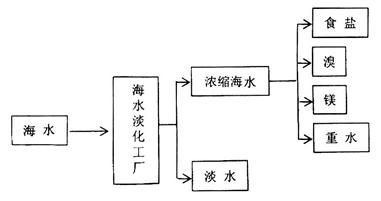
(1)海水淡化工厂通常采用的制备淡水的方法有 (写出两种)。
(2)下图是从浓缩海水中提取溴的流程图。写出下图中试剂A的化学式 ,
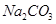 溶液中发生反应的化学方程式为 。
溶液中发生反应的化学方程式为 。

(3)制备金属镁是通过电解熔融的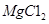 ,而不用MgO,其原因是 。
,而不用MgO,其原因是 。
(4)食盐也是一种重要的化工原料,氯碱工业就是通过电解饱和食盐水来制备NaOH、H2和Cl2。海水中得到的粗盐往往含有一些杂质,必须加入一些化学试剂,使杂质沉淀,处理后的盐水还需进入阳离子交换塔,其原因是 。电解食盐水在离子交换膜电解槽中进行,阳离子交换膜的作用是 。
【物质结构与性质】有A、B、C、D、E五种元素(A、B、C、D、E分别代表元素符号),其中A元素原子核内只有一个质子;B元素的基态原子s亚层的总电子数比p亚层的总电子数多1;C元素的原子最外层电子数是次外层电子数的3倍;D位于B的下一周期,在同周期元素形成的简单离子中,D形成的简单离子半径最小;E的基态原子中电子排布在三个能级上,且这三个能级所含电子数均相同。
(1)A、E形成的化合物E2A4每个分子中 键和
键和 键数目之比为________,B、C、E三种元素的第一电离能由大到小的顺序为_________,电负性由大到小的顺序为________(用实际元素符号表示)。
键数目之比为________,B、C、E三种元素的第一电离能由大到小的顺序为_________,电负性由大到小的顺序为________(用实际元素符号表示)。
(2)BA3易液化的主要原因是__________________。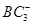 离子中B原子轨道的杂化类型为__________,离子空间构型为 。
离子中B原子轨道的杂化类型为__________,离子空间构型为 。
(3)写出D元素基态原子的核外电子排布式______________。
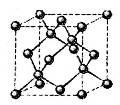
(4)E的一种单质晶胞结构如图,晶胞的边长为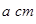 。该晶体的密度为________
。该晶体的密度为________ g(NA表示阿伏加德罗常数,E的相对原子质量为b)。
g(NA表示阿伏加德罗常数,E的相对原子质量为b)。
【有机化学基础】饱受争议的PX项目是以苯的同系物F为原料的化工项目。F中苯环上的取代基是对位关系。用质谱法测得F的相对分子质量为106,A的相对分子质量为92,A与F属于同系物。下图是以A、F为原料制得J的合成路线图。
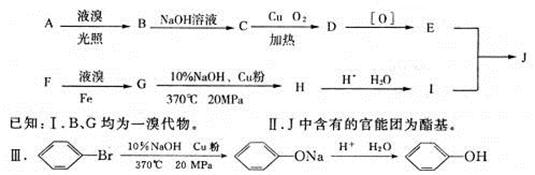
(1)写出H的结构简式:______________。
(2)C所含官能团的名称是____________,D所含官能团的名称是____________。
(3)B→C的反应类型属于_____________;C→D的反应类型属于____________;
F→G的反应类型属于____________;G→H的反应类型属于____________。
(4)写出满足以下三个条件的I的同分异构体的结构简式:______________。
i.属于芳香族化合物
ii.不与金属钠发生化学反应
iii.核磁共振氢谱有4组峰,且峰面积比为3:3:2:2。
(5)写出E和I反应最终生成J的化学方程式:____________________________________。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号