高考原创化学预测卷 01(山东卷)
化学与社会、社会密切相关,下列说法正确的是
| A.工业上利用二氧化硅在高温条件下与焦炭反应,生成单质硅和二氧化碳的原理,制取粗硅 |
| B.手指不慎被玻璃划伤流血,可向伤口上涂FeCl3溶液,是因为FeCl3溶液可杀菌消毒 |
| C.2014年山东莱芜共出现284天雾霾天气,对煤进行液化和气化等物理变化的处理,可减少雾霾天气的发生 |
| D.白酒放置一定时间香味更浓,是因为白酒中乙醇与少量的有机酸反应生成具有香味的酯 |
短周期主族元素A、B、C、D、E的原子序数依次增大,其中A与C同主族,A与其它元素不在同一周期,B与D同主族,常温下D的单质为淡黄色固体。下列推断中正确的是
A.离子半径由小到大的顺序:r(B)<r(C)<r(E)
B.元素B、D分别与A形成的化合物的热稳定性:D>B
C.元素D的氧化物对应水化物的酸性比E的弱
D.元素B与A形成的某种化合物和B与C形成的某种化合物反应,可能包含了离子键与共价键的断裂和形成
下列说法中正确的是
| A.SiO2既能与氢氟酸反应,也能与氢氧化钠溶液反应,属于两性氧化物 |
| B.已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量二氧化碳:2ClO-+CO2+H2O=2HClO+CO32- |
| C.浓盐酸和浓硫酸长期暴露在空气中,溶液浓度减小,其原理完全相同 |
| D.足量Zn与一定量浓硫酸充分反应得到混合气体,先后发生两个反应,H2SO4均为氧化剂,但变价元素不同 |
下列各图示实验操作合理的是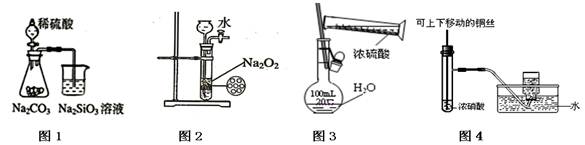
| A.图1为证明非金属性强弱:S>C>Si |
| B.图2为制备少量氧气 |
| C.图3为配制一定物质的量浓度的硫酸溶液 |
| D.图4为制备并收集少量NO2气体 |
柠檬烯是一种食用香料,其结构简式如图所示。下列有关柠檬烯的说法正确的是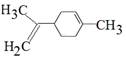
| A.它的分子式为C9H12 |
| B.柠檬醛能使溴水和酸性高锰酸钾溶液褪色,而且原理相同 |
| C.一定条件下,它可以发生加成、取代、氧化、还原、加聚等反应 |
D.它和丁基苯(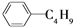 )互为同分异构体 )互为同分异构体 |
下列说法或表达正确的是
| A.加入铝粉能放出气体的溶液可能含有:NH4+、K+、Cl‾、NO3‾ |
| B.含有1 mol·L-1 Fe3+的溶液可能含有:Na+、Ca2+、I-、Br‾ |
| C.FeS溶于过量稀硝酸的离子方程式为:FeS + 2H+=Fe2+ + H2↑ |
| D.向NaHCO3溶液中加入过量的石灰水产生白色沉淀:HCO3- + Ca2+ + OH- =CaCO3↓+ H2O |
下列浓度关系正确的是
| A.0.1 mol/L的NH4HSO4溶液中滴加0.1 mol/L的Ba(OH)2溶液至沉淀刚好完全:c (NH4+)>c (OH-)>c (SO42-)>c (H+) |
| B.0.1 mol/L的KOH溶液中通入标准状况下的CO2气体3.36 L,所得溶液中:c (K+)+c (H+)=c (CO32-)+c (HCO3-)+c (OH-) |
| C.0.1 mol/L的NaOH溶液与0.2 mol/L的HCN溶液等体积混合,所得溶液呈碱性:c (HCN)>c (Na+)>c (CN-)>c (OH-)>c (H+) |
| D.pH相同的NaOH溶液、CH3COONa溶液、Na2CO3溶液、NaHCO3溶液的浓度:c (NaOH)<c (CH3COONa)<c (NaHCO3)<c (Na2CO3) |
(18分)能源的开发和利用是当前科学研究的重要课题。
(1)利用二氧化铈(CeO2)在太阳能作用下前实现如下变废为宝的过程:
mCeO2 (m-x)CeO2
(m-x)CeO2 xCe+xO2
xCe+xO2
(m-x)CeO2 xCe+xH2O+xCO2
xCe+xH2O+xCO2 mCeO2+xH2+xCO
mCeO2+xH2+xCO
上述过程的总反应平衡常数表达式为 。该反应能量转化方式为 。
(2)CH3OH、O2和KOH溶液构成的燃料电池的负极电极反应式为 。该电池反应可获得K2CO3溶液,某温度下0.5mol L-1 K2CO3溶液的pH=12,若忽略CO32-的第二级水解,则CO32- +H2O
L-1 K2CO3溶液的pH=12,若忽略CO32-的第二级水解,则CO32- +H2O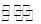 HCO3-+OH-的平衡常熟Kh= 。
HCO3-+OH-的平衡常熟Kh= 。
(3)氯碱工业是高耗能产业,下列将电解池与燃料电池相组合的工艺可以节能30%以上。
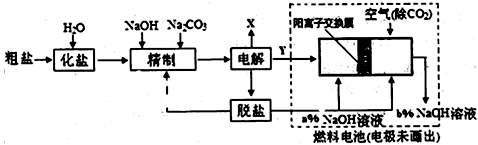
①电解过程中发生反应的离子方程式是 ,阴极附近溶液PH (填“不变”、“升高”或“下降”)。
②如果粗盐中SO42-含量较高,精制过程需添加钡试剂除去SO42-,证明SO42‾已经完全沉淀的方法是 。
现代工艺中更多使用BaCO3除SO42-,请写出发生反应的离子方程式 。
③图中氢氧化钠溶液的质量分数a% b%(填“>”、‘‘=”或“<”),,燃料电池中正极上发生的电极反应为 。
(18分)化学反应原理在科研和生产中有广泛应用。
I.已知下列热化学方程式:
CO(g)+ 1/2 O2(g)= CO2(g)△H= —283.0kJ•mol‾1 ①
2CH3OH(l)+3O2(g) = 2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1 ②
H2O(g) = H2O(l) ΔH4=-44 kJ·mol-1 ③
写出甲醇不完全燃烧生成一氧化碳气体和水蒸气的反应的热化学方程式:______________。
II.苯乙烯是合成橡胶和塑料的单体,可用来生产丁苯橡胶、聚苯乙烯、泡沫聚苯乙烯,工业上采用乙苯与CO2脱氢生产重要化工原料苯乙烯 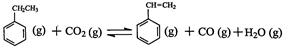 △H=-166kJ·mol-1,在2L固定容积密闭容器内,乙苯与CO2的反应在I、II、III三种不同的条件下进行实验。乙苯、CO2的起始物质的量分别为2mol和6mol,其中实验I在T1°C,0.3MPa,而实验II、III分别改变了实验其他条件。乙苯的浓度随时间的变化如图所示。
△H=-166kJ·mol-1,在2L固定容积密闭容器内,乙苯与CO2的反应在I、II、III三种不同的条件下进行实验。乙苯、CO2的起始物质的量分别为2mol和6mol,其中实验I在T1°C,0.3MPa,而实验II、III分别改变了实验其他条件。乙苯的浓度随时间的变化如图所示。
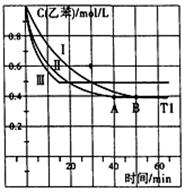
①实验I苯乙烯在0—50min的平均反应速率是___________,T1°C该反应的平衡常数为 。
②实验II、III改变的条件可能是___________________、___________________________。
③对于实验I,下列叙述能说明乙苯与CO2反应达到平衡的是_______。
a.平衡常数K不再增大
b.CO2的转化率不再增大
c.混合气体的平均相对分子质量不再改变
d.反应物不再转化为生成物
III.K2FeO4—Zn可以组成碱性电池,K2FeO4在电池中作为正极材料,其电池反应为:2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2,该电池负极材料为 、正极发生的电极反应式为 ,在酸性条件下电解水的方法制得臭氧,臭氧在阳极周围的水中产生,电极反应式3H2O-6e-=O3↑+6H+,阴极附近溶解在水中的氧气生成过氧化氢,其电极反应式为 。
(17分)海水是巨大的资源宝库,工业上从海水中提取食盐和溴的过程如下:
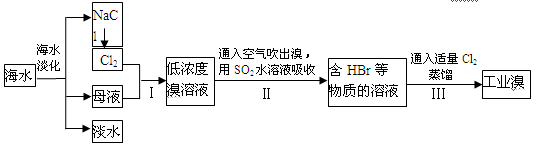
(1)可以用淀粉-KI试纸检验操作I中是否有溴生成,其操作方法是___________________。
(2)操作Ⅱ发生反应的离子方程式为_____________;可以用碳酸钠溶液代替操作Ⅱ中的二氧化硫水溶液,生成物中溴的化合价分别为+5和-1价,操作Ⅲ中如果用稀硫酸代替氯气,则操作Ⅲ中发生反应的离子方程式为______。
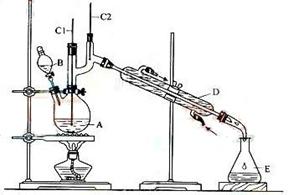
(3)溴苯是一种化工原料,可以用溴和苯反应合成。实验室合成溴苯的装置示意图如下:
下表为苯、溴和溴苯的相关数据:
| |
苯 |
溴 |
溴苯 |
| 密度/g·cm-3 |
0.88 |
3.10 |
1.50 |
| 沸点/℃ |
80 |
59 |
156 |
| 水中溶解度 |
微溶 |
微溶 |
微溶 |
回答下列问题:
(4)在A中加入30 .0mL无水苯和少量铁屑。在B中小心加入8.0 mL液态溴。向A中滴加液溴,反应一段时间后,点燃酒精灯加热蒸馏。
①在该实验中,B装置的名称是__________,A的容积最适合的是_________(填编号)
a.25mL b.50mL c.100mL d.250mL
②收集溴苯时,应根据_________(填“C1”或“C2”)所显示的温度,其温度应为_________。
③在反应开始后到收集溴苯之前,应先将F装置连接在D装置后,用它可承接的物质有_______(填化学式)。
④某化学小组设计如下实验方案,证明苯和溴发生的是取代反应而不是加成反应。
第一步:取少量反应后F装置中的溶液于试管中;第二步:向其中加入过量的稀硝酸;第三步:继续滴加少量的硝酸银溶液。如果有浅黄色沉淀生成则证明苯和溴发生的是取代反应。
该实验方案__________(填“合理”或“不合理”),理由是__________________。
【化学与技术】硫酸是工业生产中最为重要的产品之一,在化学工业的很多领域都要用到浓硫酸。
(1)在硫酸工业生产中,我国采用黄铁矿为原料生产SO2,反应的化学方程式为 ,
该反应在 中进行(填设备名称)。
(2)为了有利于SO2转化为SO3,且能充分利用热能,采用了多层催化剂且有热交换器的 (填设备名称)中进行反应。在如图所示的装置中,C处流出的气体有 ;SO3进入 (填设备名称)用____ 吸收,得到浓硫酸或发烟硫酸。

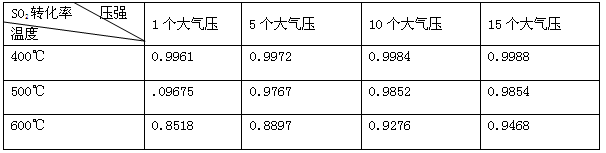
(3)实验测得SO2反应生成SO3的转化率与温度、压强有关,请根据下表信息,结合工业生产实际,选择最合适的生产条件是 。
(4)吸收塔排出的尾气中SO2的含量如果超过500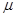 L/L,就要加以处理后才能排出,处理方法之一是用氨水洗涤烟气脱硫,用方程式表示氨水洗涤吸收塔排除的尾气的化学方程式 。
L/L,就要加以处理后才能排出,处理方法之一是用氨水洗涤烟气脱硫,用方程式表示氨水洗涤吸收塔排除的尾气的化学方程式 。
(12分)【物质结构与性质】A、B、C、D、E、F都是元素周期表中前20号元素,其原子序数依次增大。B、C、D、E同周期,A、E同主族,F和其它元素既不在同周期也不在同主族。B、D、E的最高价氧化物的水化物均能互相反应生成盐和水,E的原子半径是同周期原子中最小的。
根据以上信息,回答下列问题:
(1)上述B、C、D、E四种元素中第一电离能由小到大的顺序是 ,电负性由大到小的顺序是 ,A、B、D、E离子半径由小到大的顺序为 (填相关元素或离子的符号)。
(2)A和E的氢化物中,沸点较高的是 (填相关物质的分子式);其原因是 。
(3)A和F可形成离子化合物,其晶胞结构如图所示:则每个晶胞中含阳离子的数目为 ,含阴离子的数目为 ,该离子化合物的化学式为 。
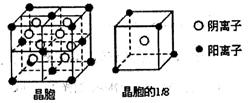
【有机化学基础】重要的精细化学品M和N,常用作交联剂、涂料、杀虫剂等,合成路线如下图所示:
已知:
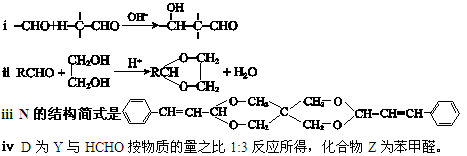
请回答下列问题:
(1)A的结构简式是 ;由D生成E的反应类型是 。
(2)C和F在一定条件下可反应生成一种有香味的物质。写出该反应的化学方程式 。
(3)下列说法正确的是 。
a.E能发生消去反应
b.1 molM中含有4 mol酯基
c.B与Y互为同系物
(4)写出由Y生成D的化学方程式 。
(5)写出同时满足下列三个条件的F的同分异构体的结构简式 。
a.与F官能团种类和数目都相同
b.苯环上只有一个侧链
c.核磁共振H谱图中出现6或7个峰
 粤公网安备 44130202000953号
粤公网安备 44130202000953号