广东省六校联盟高三第三次联考理科综合化学试卷
下列说法正确的是
| A.石油的分馏和煤的气化都是发生了化学变化 |
| B.纤维素、油脂和蛋白质在一定条件下都能水解 |
| C.二氧化硅是半导体材料,可将太阳能直接转化为电能 |
| D.乙烯和苯都能使酸性KMnO4溶液褪色 |
下列离子在溶液中能大量共存的一组是
| A.K+、H+、ClO-、SO32- | B.Fe3+、Mg2+、NO3-、CO32- |
| C.Na+、Ca2+、HCO3-、OH- | D.Al3+、NH4+、Cl-、SO42- |
设nA表示阿伏加德罗常数的数值。下列说法正确的是
| A.标准状况下,11.2LCHCl3含有0.5nA个CHCl3分子 |
| B.常温常压下,16gO3含有8nA个电子 |
| C.1L0.1mol/L醋酸溶液中含有0.1nA个氢离子 |
| D.27g铝片投入足量浓HNO3中生成nA个NO分子 |
下列有关物质性质的描述和该性质的应用均正确的是
| A.氨气具有氧化性,用浓氨水检验氯气管道是否泄漏 |
| B.铜的金属活泼性比铁的弱,可在铁闸上装若干铜块以减缓其腐蚀 |
| C.二氧化硫具有还原性,用二氧化硫水溶液吸收溴蒸气 |
| D.二氧化锰具有较强的的氧化性,可作H2O2分解的氧化剂 |
下列有关说法正确的是
| A.AlCl3溶液蒸干、灼烧至恒重,最终剩余固体是AlCl3 |
| B.向煮沸的1mol·L-1NaOH溶液中滴加FeCl3饱和溶液可制备Fe(OH)3胶体 |
| C.等体积pH=12的氨水和pH=12的NaOH溶液可中和含等物质的量HCl的盐酸 |
| D.锅炉中沉积的CaSO4可用饱和Na2CO3溶液浸泡,再将不溶物用酸去除 |
50℃时,0.1mol·L-1Na2CO3溶液pH=12,下列判断正确的是
| A.c(OH-)=10-2mol·L-1 |
| B.加入少量NaOH固体,c(Na+)和c(CO32-)均增大 |
| C.c(Na+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-) |
| D.2c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) |
短周期主族元素X、Y、Z、W的原子序数依次增大,原子半径r(W)>r(Y)>r(Z)>r(X)。X与W同主族,Z原子最外层电子数是其内层电子总数的3倍,Z原子的核电荷数等于X、Y原子核电荷数之和。下列说法正确的是
| A.工业上常用电解的方法制备W的单质 |
| B.元素Z的简单气态氢化物的热稳定性比Y的强 |
| C.仅由X、Y、Z三种元素形成的化合物的水溶液一定呈碱性 |
| D.化合物X2Z2与W2Z2所含化学键类型完全相同 |
下述根据下列操作和现象,所得结论正确的是
| |
实验操作及现象 |
实验结论 |
| A |
分别向2mL0.1mol·L-1CH3COOH溶液和2mL0.1mol·L-1H3BO3溶液中滴加等浓度的NaHCO3溶液,前者有气泡产生,后者无明显现象 |
酸性:CH3COOH>H2CO3>H3BO3 |
| B |
向浓度均为0.1mol·L-1NaCl和NaI混合溶液中滴加少量AgNO3溶液,产生黄色沉淀 |
溶度积:Ksp(AgCl)<Ksp(AgI) |
| C |
向无水乙醇中加入浓H2SO4,加热,产生的气体通入酸性KMnO4溶液,紫色褪去 |
证明生成了乙烯 |
| D |
将少量的溴水滴入NaI溶液中,再滴加CCl4,振荡、静置,溶液分为两层:上层溶液无色,下层溶液紫红色 |
氧化性:Br2>I2 |
(16分)香豆素是用途广泛的香料,合成香豆素的路线如下(其他试剂、产物及反应条件均省略):
(1)Ⅰ的分子式为 ;1molⅠ与足量氧气完全燃烧消耗氧气的物质的量为 mol。
(2)物质Ⅳ中含氧官能团的名称 ,反应④的反应类型是 。
(3)香豆素在过量NaOH溶液中完全反应的化学方程式为 。
(4)Ⅴ是香豆素的同分异构体,写出符合下列条件的Ⅴ的结构简式 。
①苯环上只有两个处于对位的取代基②能使氯化铁溶液呈紫色③能发生银镜反应
(5)一定条件下, 与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物的结构简式为 。
与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物的结构简式为 。
(16分)I.合成氨的原料气H2可通过反应CO(g)+H2O(g) CO2(g)+H2(g)获取。
CO2(g)+H2(g)获取。
(1)T℃时,向容积固定为5L的容器中充入1mol水蒸气和1molCO,反应达平衡后,测得CO的浓度为0.08mol·L-1,则平衡时CO的转化率为 ,该温度下反应的平衡常数K值为 。
(2)保持温度仍为T℃,改变水蒸气和CO的初始物质的量之比,充入固定容器中进行反应,下列描述能够说明体系处于平衡状态的是 (填序号)。
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成amolCO2的同时消耗amolH2
d.混合气中n(CO):n(H2O):n(CO2):n(H2)=1:16:6:6
II.(1)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨在燃烧实验中相关的反应有:
①4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H1
②4NH3(g)+5O2(g)=4NO(g)+6H2O(l) △H2
③4NH3(g)+6NO(g)=5N2(g)+6H2O(l) △H3
请写出上述三个反应中△H1、△H2、△H3三者之间关系的表达式,△H1= 。
(2)美国Simons等科学家发明了使NH3直接用于燃料电池的方法,其装置用铂作为电极、加入碱性电解质溶液,其电池反应为4NH3+3O2=2N2+6H2O
①写出该燃料电池的正极反应式 。
②若用该燃料电池产生的电能在铁皮上镀锌(制白铁皮),某铁皮上现需要镀上9.75g锌,理论上至少需要消耗标准状况的氨气 L。
III.(1)下图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态)。由图可知Mg与卤素单质的反应均为 (填“放热”或“吸热”)反应。
(2)金属Mg与CH3Cl在一定条件下反应可生成CH3MgCl,CH3MgCl是一种重要的有机合成试剂,易与水发生水解反应并有无色无味气体和沉淀生成。写出CH3MgCl水解的化学方程式 。
(16分)污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已省略)。
请回答下列问题:
(1)上述流程中多次涉及到过滤操作,实验室进行过滤操作时需要用到的硅酸盐仪器有玻璃棒、 、 ;其中玻璃棒的作用是 。
(2)用MnCO3能除去溶液中的Al3+和Fe3+,其原理是 。
(3)已知Ksp(CuS)=8.4×10-45,Ksp(NiS)=1.4×10-24;在除铜镍的过程中,当Ni2+恰好完全沉淀(此时溶液中c(Ni2+)=1.0×10-5mol/L),溶液中Cu2+的浓度是 mol/L。
(4)工业上采用电解K2MnO4水溶液的方法来生产KMnO4,其中隋性电极作阳极,铁作阴极,请写出阳极的电极反应式 。
(5)下列各组试剂中,能准确测定一定体积燃煤尾气中SO2含量的是__________。(填编号)
a.NaOH溶液、酚酞试液 b.稀H2SO4酸化的KMnO4溶液
c.碘水、淀粉溶液 d.氨水、酚酞试液
(6)除杂后得到的MnSO4溶液可以通过 (填操作名称)制得硫酸锰晶体(MnSO4•H2O,相对分子质量为169)。已知废气中SO2浓度为8.4g/m3,软锰矿浆对SO2的吸收率可达90%,则处理1000m3燃煤尾气,可得到硫酸锰晶体质量为 kg(结果保留3位有效数字)。
(16分)草酸(H2C2O4)是一种二元弱酸,部分性质如下:能溶于水,易溶于乙醇;大约在175℃升华(175℃以上分解生成H2O、CO2和CO);H2C2O4+Ca(OH)2=CaC2O4↓+2H2O。现用H2C2O4进行如下实验:
(一)探究草酸的不稳定性
通过如图实验装置验证草酸受热分解产物中的CO2和CO,A、B、C中所加入的试剂分别是: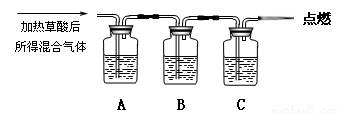
A、乙醇 B、 C、NaOH溶液。
(1)B中盛装的试剂 (填化学式)
(2)A中加入乙醇的目的是 。
(二)探究草酸的酸性
将0.01mol草酸晶体(H2C2O4·2H2O)加入到100ml0.2mol/L的NaOH溶液中充分反应,测得反应后溶液呈碱性,其原因是 (用离子方程式表示)。
(三)用酸性KMnO4溶液与H2C2O4溶液反应来探究影响化学反应速率的因素
I、实验前先用酸性KMnO4标准溶液滴定未知浓度的草酸
反应原理: MnO4-+ H2C2O4+ = Mn2++ CO2↑+ H2O
(1)配平上述离子方程式。
(2)滴定时KMnO4溶液应盛装于 (填“酸式”或“碱式”)滴定管中。
Ⅱ、探究影响化学反应速率的因素
| 实验组别 |
c(H2C2O4) /(mol/L) |
V(H2C2O4) /ml |
c(KMnO4) /(mol/L) |
V(KMnO4) /ml |
c(H2SO4) /(mol/L) |
褪色所需时间 |
实验 目的 |
| 1 |
0.2 |
2 |
0.0025 |
4 |
0.12 |
6'55'' |
(a) |
| 0.2 |
2 |
0.005 |
4 |
0.12 |
5'17'' |
|
|
| 0.2 |
2 |
0.01 |
4 |
0.12 |
3'20'' |
|
|
| 0.2 |
2 |
0.02 |
4 |
0.12 |
9'05'' |
|
|
| 0.2 |
2 |
0.03 |
4 |
0.12 |
11'33'' |
|
|
| 0.2 |
2 |
0.04 |
4 |
0.12 |
14'20'' |
|
|
下表列出了在“探究影响化学反应速率的因素”实验中得出的部分实验数据:
请回答:
(1)实验目的(a)是 ;
(2)根据表中数据在坐标中画出反应褪色所需时间随KMnO4溶液浓度的变化关系图像;
(3)若要探究催化剂对该反应速率的影响应选择MnSO4而不选MnCl2作为催化剂,其原因是 。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号