期中备考总动员高三化学模拟卷【新课标I卷】3
化学与生产、生活、社会密切相关,下列有关说法不正确的是
| A.多用电子邮件、MSN、QQ等即时通讯工具,少用传真打印机属于“低碳生活”方式 |
| B.我国神七宇航员所穿 航天服主要成分是由碳化硅、陶瓷和碳纤维复合而成的,它是一种新型无机非金属材料 |
| C.食品保鲜膜、一次性食品袋的主要成分是聚氯乙烯 |
| D.使用纤维素和淀粉为原料制成的微生物降解塑料,可治理“白色污染” |
【改编】下列关于①乙烯②苯③乙醇④乙酸⑤葡萄糖等有机物的叙述不正确的是
| A.④⑤与新制的Cu(OH)2悬浊液反应的原理相同 |
| B.②③④能发生取代反应 |
| C.①②都可使溴水褪色,但原理不同 |
| D.一定条件下,⑤可以转化为③ |
【改编】参照反应Br+
 HBr+H的能量对反应历程的示意图,下列叙述中正确的是
HBr+H的能量对反应历程的示意图,下列叙述中正确的是

| A.该反应为可逆反应 |
| B.加人催化剂,可提高HBr的产率 |
| C.反应物总能量低于生成物总能量 |
| D.升高温度正反应速率与逆反应速率同程度增大 |
Na、Al、Fe、Cu是中学化学中重要的金属元素,它们的单质及其化合物之间有很多转化关系,如通常所说的“铁三角”、“铝三角”等。下表所列物质不能按如图(“→”表示一步完成)关系相互转化的是

| 选项 |
A |
B |
C |
D |
| A |
Na |
Al |
Fe |
Cu |
| B |
NaOH |
Al2O3 |
FeCl3 |
CuSO4 |
| C |
NaCl |
Al(OH)3 |
FeCl2 |
CuCl2 |
【原创】常温下,下列溶液中说法正确的是
| A.0.2mol·L-1氨水中滴入0.2mol·L-1CH3COOH溶液可能存在:c(NH4+)-(CH3COO-)>c(OH-)- c(H+) |
| B.pH=5.6的NaHSO3溶液:c(Na+)>c(HSO3-)>c(H2SO3)>c(SO32-) |
| C.向BaSO4悬浊液中加入Na2SO4固体,Ksp(BaSO4)变小 |
| D.若POH=-lgc(OH-),则PH=3的盐酸与POH=3的氨水等体积混合溶液,PH>7 |
下列与化学反应能量变化相关的叙述正确的是
| A.生成物能量一定低于反应物总能量 |
| B.相同条件下,2mol氢原子所具有的能量小于1mol氢分子所具有的能量 |
| C.根据盖斯定律,可计算某些难以直接测定的化学反应的反应焓变 |
D.同温同压下, 在光照和点燃条件的 在光照和点燃条件的 不同 不同 |
从海带中制取单质碘需要经过灼烧、溶解、过滤、氧化、萃取、分液、蒸馏等操作。下列图示对应的装置合理、操作规范的是
常见的一硝基甲苯有对硝基甲苯和邻硝基甲苯两种,均可用于合成各种染料。某探究小组利用下列反应和装置制备一硝基甲苯。

实验中可能用到的数据:

实验步骤:
①按体积比1:3配制浓硫酸与浓硝酸混合物40 mL;
②在三颈瓶中加入15 mL(13g)甲苯,按图所示装好药品和其他仪器;
③向三颈瓶中加入混酸,并不断搅拌(磁力搅拌器已略去);
④控制温度约为50℃,反应大约10 min,三颈瓶底有大量淡黄色油状液体出现;
⑤分离出一硝基甲苯的总质量13.60 g。
请回答下列问题:
(1)配制混酸的方法是_ _。反应中需不断搅拌,目的是_______________________________________________。
(2)仪器A的名称是________ ,使用该仪器前必须进行的操作是_________。
(3)若实验后在三颈瓶中收集到的产物较少,可能的原因是_________。
(4)分离反应后产物的方案如下:

其中,操作1的名称为________,操作2中需要使用下列仪器中的________(填序号)。
| A.冷凝管 |
| B.酒精灯 |
| C.温度计 |
| D.分液漏斗 |
E.蒸发皿
(5)该实验中一硝基甲苯的产率为________(保留两位有效数字)。
【改编】五种固体物质A、B、C、D、E由下表中不同的阴阳离子组成,它们均易溶于水。
| 阳离子 |
Na+ Al3+ Fe3+ Cu2+、 Ba2+ |
| 阴离子 |
OH-Cl-CO32-NO3-SO4- |
分别取它们的水溶液进行实验,结果如下:
①A溶液与C溶液混合后产生蓝色沉淀,向该沉淀中加入足量稀HNO3,沉淀部分溶解,剩余白色固体;
②B溶液与E溶液混合后产生红褐色沉淀,同时产生大量气体;
③少量C溶液与D溶液混合后产生白色沉淀,过量C溶液与D溶液混合后无现象;
④B溶液与D溶液混合后无现象;
⑤将38.4 g Cu片投入装有足量D溶液的试管中,Cu片不溶解,再滴加500mL1.6 mol·L-1稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现。
(1)据此推断A、D的化学式为:A ;D 。
(2)写出步骤①中生成沉淀的反应的离子方程式 。
(3)E溶液中各离子的物质量浓度由小到大的顺序为 。若向E的饱和溶液中通入足量的CO2,现象是 ,原因是 (用化学方程式及必要的文字说明解释)。
(4)步骤⑤中Cu片 (填“能”或“不能”)完全溶解。产生的有害气体可用 吸收。
(5)若用惰性电极电解A和B的混合溶液,溶质的物质的量均为0.1 mol,请在坐标系中画出通电后阳极产生气体的体积(标准状况下)V与通过电子的物质的量n的关系(不考虑气体溶于水)。

尿素[CO(NH2)2]是首个由无机物人工合成的有机物。工业上合成尿素的反应如下:
2NH3(g)+CO2(g)  CO(NH2)2(l) + H2O (l) ΔH<0。回答下列问题:
CO(NH2)2(l) + H2O (l) ΔH<0。回答下列问题:
已知工业上合成尿素分两步进行,相关反应如下:
反应Ⅰ:2NH3(g)+CO2(g)  NH2COONH4(s) ΔH1<0
NH2COONH4(s) ΔH1<0
反应Ⅱ:NH2COONH4(s)  CO(NH2)2(l)+ H2O (l) ΔH2>0
CO(NH2)2(l)+ H2O (l) ΔH2>0
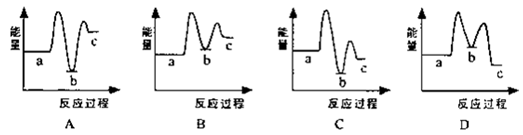
(1)下列示意图中[a表示2NH3(g)+CO2(g),b表示NH3COONH4(s),c表示CO(NH2)2(l)+H2O(l)],能正确表示尿素合成过程中能量变化曲线是(填序号) 。
(2)某实验小组模拟工业上合成尿素的条件,在恒定温度下,将氨气和二氧化碳按2:1的物质的量之比充入一体积为10L的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经20min达到平衡,各物质浓度的变化曲线如下图所示。

从图中得知∆c(CO2)=0.2mol/L,则v(CO2)= ∆c(CO2)/t= 0.01mol·L-1·min-1。
①在上述条件下,从反应开始至20min时,二氧化碳的平均反应速率为 。
②为提高尿素的产率,下列可以采取的措施有 。
| A.缩小反应容器的容积 |
| B.升高温度 |
| C.平衡体系中及时分离出CO(NH2)2 |
| D.使用合适的催化剂 |
③该反应的平衡常数表达式K= ;若升高体系的温度,容器中NH3的体积分数将 (填“增加”、“减小”或“不变”)。
④若保持平衡的温度和体积不变,25min时再向容器中充入2mol氨气和1mol二氧化碳,在40min时重新达到平衡,请在上图中画出25~50min内氨气的浓度变化曲线。
[化学——选修3:物质结构与性质]已知A、B、C、D四种短周期元素,它们的核电荷数依次增大。A与C原子的基态电子排布中L能层都有两个未成对电子,C、D同主族。 E、F都是第四周期元素,E原子的基态电子排布中有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满。根据以上信息填空:
(1)基态D原子中,电子占据的最高能层符号 ,该能层具有的原子轨道数为 。
(2)E2+离子的价层电子排布图是 ,F原子的电子排布式是 。
(3)A元素的最高价氧化物对应的水化物中心原子采取的轨道杂化方式为 ,B元素的气态氢化物的VSEPR模型为 。
(4)化合物AC2、B2C和阴离子DAB-互为等电子体,它们结构相似,DAB-的电子式为 。
(5)配合物甲的焰色反应呈紫色,其内界由中心离子E3+与配位体AB-构成,配位数为6,甲的水溶液可以用于实验室中E2+离子的定性检验,检验E2+离子的离子方程为 。
(6)某种化合物由D,E,F三种元素组成,其晶胞如图所示,则其化学式为 ,该晶胞上下底面为正方形,侧面与底面垂直,根据图中所示的数据列式计算该晶体的密度d= g/cm3。(保留两位小数)

[化学——选修5:有机化学基础]以甲苯为原料可以合成某种食用香料(有机物G)和某种治疗肺结核药物的有效成分(有机物PAS-Na)的路线如下:


回答下列问题:
(1)由B生成C的反应类型是 。
(2)肉桂酸中含氧官能团的名称是 。
(3)写出由A生成B的化学方程式: 。
(4)质谱图显示试剂b的相对分子质量为58,分子中不含甲基,且为链状结构,写出肉桂酸与试剂b生成G的化学方程式: 。
(5)当试剂d过量时,可以选用的试剂d是 (填字母序号)。
a.NaOH b.Na2CO3 c.NaHCO3
(6)写出C与NaOH反应的化学方程式: 。
(7)在肉桂酸分子中碳碳双键催化加氢后得到化合物X(分子式为C9H10O2),X有多种同分异构体,符合下列条件的有 种。
a.苯环上有两个取代基;
b.能发生银镜反应;
c.与Na作用有H2产生
 粤公网安备 44130202000953号
粤公网安备 44130202000953号