期中备考总动员高三化学模拟卷【江苏】2
2014年12月科学家发现了迄今为止最轻的冰——“冰十六”,它是水的一种结晶形式,有着像笼子一样、可以困住其他分子的结构。下列有关叙述中不正确的是
| A.冰的密度比液态水小 |
| B.冰与干冰由不同分子构成 |
| C.“冰十六”可以包合气体分子 |
| D.液态水转变成“冰十六”是化学变化 |
下列有关化学用语表示正确的是
A.氢氧化钠的电子式: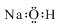 |
B.Cl-的结构示意图: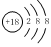 |
C.2-丁醇的结构简式: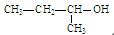 |
| D.碳酸的电离方程式:H2CO3=2H++CO32- |
【原创】常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.使酚酞变红色的溶液:Na+、Mg2+、NO3-、SO42- |
| B.pH=1的溶液:Na+、K+、NO3-、ClO- |
| C.滴加KSCN溶液显红色的溶液:NH4+、K+、Cl-、SO42- |
| D.0.1 mol·L-1 Na2CO3溶液: Na+、Ba2+、Cl-、OH- |
下列物质性质与应用对应关系正确的是
| A.钠和钾的合金具有导电性,可用于快中子反应堆热交换剂 |
| B.明矾溶于水能产生Al(OH)3胶体,可用作净水剂 |
| C.甲醛能使蛋白质变性,可用于食品防腐剂 |
| D.水玻璃易溶于水,可用于生产黏合剂和防火剂 |
下列离子方程式正确的是
| A.醋酸除去水垢中的CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑ |
| B.向NaAlO2溶液中通入过量CO2:2AlO2-+ CO2 + 3H2O = 2A(OH)3↓+ CO32- |
| C.将过量二氧化硫气体入冷氨水中:SO2+NH3·H2O=HSO3-+NH4+ |
| D.用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O=3I 2+6OH- |
NaOH标准溶液的配制和标定,需经过NaOH溶液配制、基准物质H2C2O4•2H2O的称量以及用NaOH溶液滴定等操作。下列有关说法正确的是
| A.用图甲所示操作转移NaOH溶液到容量瓶中 |
| B.用图乙所示装置准确称得0.1575gH2C2O4•2H2O固体 |
| C.用图丙所示操作排除碱式滴定管中的气泡 |
| D.用图丁所示装置以NaOH待测液滴定H2C2O4溶液 |
下列各组物质中,不满足组内任意两种物质在一定条件下均能发生反应的是
| |
甲 |
乙 |
丙 |
| A |
Na |
H2O |
Cl2 |
| B |
Al |
Fe2O3 |
稀H2SO4 |
| C |
CH3CH2OH |
NaOH溶液 |
CH3COOH |
| D |
Ba(OH)2溶液 |
CO2 |
Na2CO3溶液 |
【原创】设NA为阿伏加德罗常数的值。下列说法正确的是
| A.标准状况下,22.4L乙醇中含乙醇分子数目为NA |
| B.1mol由乙烯和丙烯组成的混合气体中含碳原子数目为2NA |
| C.78gNa2O2固体中含离子总数目为3NA |
| D.0.1mol Cl2通入水中,转移电子的数目为0.1NA |
【原创】短周期主族元素X、Y、Z、W,己知它们的简单离子的电子层结构均相同,Y原子最外层电子数为内层的3倍,X是地壳中含量最多的金属元素,Z没有正化合价,W为短周期中最活泼的金属。下列说法正确的是
| A.原子半径:r(w)>r(X)>r(Y)>r(Z) |
| B.X的最高价氧化物的水化物碱性比W的强 |
| C.Y的简单氢化物的稳定性比Z的强 |
| D.X、W的单质均可以通过电解其氯化物制备 |
已知:①2H2(g)+O2(g)=2H2O (g) △H1
②3H2(g)+Fe2O3(s)=2Fe(s)+3H2O (g) △H2
③2Fe(s)+3/2O2(g)=Fe2O3(s) △H3
④2Al(s)+3/2O2(g)=Al2O3(s) △H4
⑤2Al(s)+Fe2O3(s)=Al2O3(s)+2Fe(s) △H5
下列关于上述反应焓变的判断正确的是
| A.△H1<0,△H3>0 | B.△H5<0,△H4<△H3 |
| C.△H1=△H2+△H3 | D.△H3=△H4+△H5 |
下列有关说法正确的是
| A.铁表面镀铜时,铜与电源的正极相连,铁与电源的负极相连 |
| B.用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大 |
| C.一定温度下,反应2Mg(s)+CO2(g)=2MgO(s)+C(s)能自发进行,则该反应△H<0 |
D.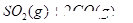 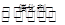  达到平衡,保持其他条件不变,分离出硫,正反应速率加快,SO2的转化率提高 达到平衡,保持其他条件不变,分离出硫,正反应速率加快,SO2的转化率提高 |
【改编】盆栽鲜花一般需施用S-诱抗素制剂,以保证鲜花长期盛开。S-诱抗素的分子结构如图,下列关于该物质的说法正确的是
| A.每个分子中含有1个手性碳原子 |
| B.能发生消去反应 |
| C.既能与FeCl3溶液发生显色反应,又能使溴水褪色 |
| D.1mol该物质与NaOH溶液反应,最多可消耗1mol NaOH溶液 |
在研究金属钠与水反应的实验中,下列根据实验现象得出的结论不正确的是
| A.将一小块Na投入水中,钠浮于水面,说明钠密度比水小 |
| B.将一小块Na投入滴有酚酞的水中,溶液变红,说明反应生成了碱 |
| C.将一小块Na投入CuSO4溶液中,生成蓝色沉淀,说明Na没有Cu活泼 |
| D.点燃Na与肥皂水反应产生的气泡,有尖锐爆鸣声,说明有H2生成 |
常温下,下列溶液中有关微粒的物质的量浓度关系正确的是
A.0.1 mol·L-1 (NH4)2Fe(SO4)2溶液:c(SO42-)>c( )>c(Fe2+)>c(H+) )>c(Fe2+)>c(H+) |
B.0.1 mol·L-1 NaHCO3溶液:c(Na+)+c(H+)=c( )+c( )+c( )+c(OH-) )+c(OH-) |
| C.0.1 mol·L-1Na2S溶液:2c(Na+) =c(S2-)+c(HS-) +c(H2S) |
| D.0.01 mol·L-1NaOH溶液与等体积pH=2的醋酸混合后的溶液:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
【改编】900℃时,向1.0L恒容密闭容器中充入0.40mol乙苯,发生反应: 。经一段时间后达到平衡。反应过程中测定的部分数据见下表:
。经一段时间后达到平衡。反应过程中测定的部分数据见下表:
| 时间/min |
0 |
10 |
20 |
30 |
40 |
| n(乙苯)/mol |
0.40 |
0.30 |
0.24 |
n2 |
n3 |
| n(苯乙烯)/mol |
0.00 |
0.10 |
n1 |
0.20 |
0.20 |
下列说法正确的是
A.反应在前10 min的平均速率为v(H2)=0.01mol·L-1·min-1
B.保持其他条件不变,升高温度,平衡时,c(H2)=0.22mol·L-1,则a<0
C.保持其他条件不变,压缩容器的体积为原来的一半,则乙苯的转化率大于50.0%
D.相同温度下,起始时向容器中充入0.10mol乙苯、0.10mol苯乙烯和0.20molH2,达到平衡前v(正)>v(逆)
【改编】亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:

已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O。
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
请回答下列问题:
(1)发生器中反应的化学方程式为 ;为了增加生产的安全性在发生器中还需要进行的操作为 。
(2)吸收塔产生的气体X为 (化学式)。
(3)吸收塔的温度不能超过20℃,原因是 。
(4)滤渣的成分为 (化学式)。
(5)从滤液中得到NaClO2•3H2O晶体需要洗涤,为了减少溶解损失可以用 洗涤NaClO2•3H2O晶体。
用于合成降血压药物奈必洛尔中间体G的部分流程如下:

已知:乙酸酐的结构简式为 ,请回答下列问题:
,请回答下列问题:
(1)G物质中的含氧官能团的名称是 、 。
(2)反应A→B的化学方程式为 。
(3)上述④、⑤变化过程的反应类型分别是 、 。
(4)写出满足下列条件的C的同分异构体的结构简式: 、 。
Ⅰ.苯环上只有两种取代基。
Ⅱ.分子中只有4种不同化学环境的氢。
Ⅲ.能与NaHCO3反应生成CO2。
(5)根据已有知识并结合相关信息,写出以 和乙酸酐为原料制备
和乙酸酐为原料制备 的合成路线流程图(无机试剂任选)。 。
的合成路线流程图(无机试剂任选)。 。
合成路线流程图示例如下:

【改编】黄钾铵铁矾[KNH4Fex(SO4)y(OH)z]不溶于水和稀硫酸,制取黄钾铵铁矾的流程如下:

(1)黄钾铵铁矾[KNH4Fex(SO4)y(OH)z]中x、y、z的代数关系式为 。
(2)检验滤液中是否存在NH4+的操作是 。
(3)黄钾铵铁矾的化学式可通过下列实验测定:
①称取一定质量的样品加入稀硝酸充分溶解,将所得溶液转移至容量瓶并配制成100.00 mL溶液A。
②量取25.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体9.32 g。
③量取25.00 mL溶液A,加入足量NaOH溶液,加热,收集到标准状况下气体224mL,同时有红褐色沉淀生成。
④将步骤③所得沉淀过滤、洗涤、灼烧,最终得固体4.80 g。
通过计算确定黄钾铵铁矾中n(OH-): n(NH4+)(写出计算过程) 。
目前,回收溴单质的方法主要有水蒸气蒸馏法和萃取法等。某兴趣小组通过查阅相关资料拟采用如下方案从富马酸废液(含溴0.27%)中回收易挥发的Br2:

(1)操作X所需要的主要玻璃仪器为 ;反萃取时加入20%的NaOH溶液,其离子方程式为 。
(2)反萃取所得水相酸化时,需缓慢加入浓硫酸,并采用冰水浴冷却的原因是 。
(3)溴的传统生产流程为先采用氯气氧化,再用空气水蒸气将Br2吹出。与传统工艺相比,萃取法的优点是 。
(4)我国废水三级排放标准规定:废水中苯酚的含量不得超过1.00mg/L。实验室可用一定浓度的溴水测定某废水中苯酚的含量,其原理如下:

①请完成相应的实验步骤:
步骤1:准确量取25.00mL待测废水于250mL锥形瓶中。
步骤2:将4.5 mL 0.02mol/L溴水迅速加入到锥形瓶中,塞紧瓶塞,振荡。
步骤3:打开瓶塞,向锥形瓶中加入过量的0.1mol/L KI溶液,振荡。
步骤4: ,再用0.01 mol/L Na2S2O3标准溶液滴定至终点,消耗 Na2S2O3溶液15 mL。(反应原理:I2 + 2Na2S2O3 =" 2NaI" + Na2S4O6)
步骤5:将实验步骤1~4重复2次。
②该废水中苯酚的含量为 mg/L。
③步骤3若持续时间较长,则测得的废水中苯酚的含量 (填“偏高”、“偏低”或“无影响”)。
研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下放热反应:
2NO2(g)+NaCl(s)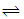 NaNO3(s)+ClNO(g) K1 ∆H ="a" kJ/mol (I)
NaNO3(s)+ClNO(g) K1 ∆H ="a" kJ/mol (I)
2NO(g)+Cl2(g)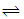 2ClNO(g) K2 ∆H ="b" kJ/mol (II)
2ClNO(g) K2 ∆H ="b" kJ/mol (II)
(1)反应4NO2(g)+2NaCl(s)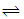 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示),∆H= kJ/mol(用a、b表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示),∆H= kJ/mol(用a、b表示)。
(2)为研究不同条件对反应(II)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(II)达到平衡。测得10min内v(ClNO)=7.5×10-3mol•L-1•min-1,则平衡后
n(Cl2)= mol。其它条件保持不变,反应(II)在恒压条件下进行,平衡常数
K2 (填“增大”“减小”或“不变”)。
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol•L‾1的CH3COONa溶液,则两溶液中c(NO3‾)、c(NO2-)和c(CH3COO‾)由大到小的顺序为 。(已知HNO2的电离常数Ka=7.1×10-4mol•L‾1,CH3COOH的电离常数K a=1.7×10-5mol•L‾1)
(4)由有机阳离子、Al2Cl7—和AlCl4—组成的离子液体作电解液时,可在钢制品上电镀铝。钢制品应接电源的 极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为 。若改用AlCl3水溶液作电解液,则阴极产物为 。
选做题(本题包括A、B两小题,请选定其中一小题,并在相应的答题区域内作答。若多做,则按A小题评分)
A.【原创】[物质结构与性质]
氮元素可形成氢化物、氮化物、叠氮化物、卤化物等多种化合物。
(1)肼(N2H4)可用作火箭燃料,1mol N2H4中含有σ键的数目为 。
(2)F2和过量NH3在铜催化作用下反应生成NF3,写出基态铜原子的电子排布式 ;
NF3分子的空间构型为 。
(3)与N3-互为等电子体的一种分子为 (填化学式)。
(4)氰酸(HCN)中碳原子的杂化方式为 。
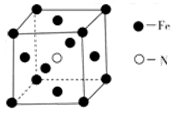
(5)铁和氨气在640℃发生置换反应生成铁氮化合物,其晶胞结构如图所示,该晶体的化学式为 。
《实验化学》
甲苯氧化法制备苯甲酸的反应原理如下:
 + 2KMnO4
+ 2KMnO4
 +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O
 + HCl
+ HCl
 +KCl
+KCl
实验时将一定量的甲苯和KMnO4溶液置于图1装置中,在100 ℃时, 反应一段时间,再停止反应,并按如下流程分离出苯甲酸和回收未反应的甲苯。

(1)实验室中实现操作Ⅰ所需的玻璃仪器有 、烧杯;操作Ⅱ的名称为 。
(2)如果滤液呈紫色,要先加亚硫酸氢钾,然后再加入浓盐酸酸化,若无此操作会出现的危害是 。
(3)在操作Ⅲ中,抽滤前需快速冷却溶液,其原因是 ;如图2所示抽滤完毕,应先断开 之间的橡皮管。
(4)纯度测定:称取1.220 g产品,配成100 mL溶液,取其中25.00 mL溶液,进行滴定 ,消耗KOH物质的量为2.4×10-3 mol。产品中苯甲酸质量分数为 。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号