广东省深圳市高三第一次调研考试理综化学试卷
下列有关说法中,正确的是
| A.光导纤维、聚酯纤维、棉花都属于有机高分子化合物 |
| B.在大米酿酒的过程中,淀粉最后变成了单糖 |
| C.“地沟油”经过加工处理后可以用来制肥皂 |
| D.明矾和漂白粉处理自来水,二者的作用原理相同 |
NA为阿伏加德罗常数。下列说法正确的是
| A.20g重水(2H2O)含有的中子数为10 NA |
| B.常温常压下,7.1g Cl2完全溶于水转移电子数为0.1NA |
| C.标准状况下,2.24L CCl4中含有C—Cl键数为0.4NA |
| D.1 mol·L-1 FeCl3溶液含有的Cl-数为3NA |
下列陈述Ⅰ、Ⅱ正确并且有因果关系的是
| 选项 |
陈述I |
陈述II |
| A |
KSCN可用来检验Fe3+ |
用KSCN溶液检验FeSO4是否变质 |
| B |
盐的水解是吸热反应 |
加热可提高水解反应速率 |
| C |
H2O2有氧化性 |
双氧水能使酸性KMnO4溶液褪色 |
| D |
Al(OH)3是两性氢氧化物 |
Al(OH)3可溶于过量浓氨水中 |
下列离子方程式错误的是
| A.石灰石和盐酸反应制CO2:CaCO3 + 2H+ = CO2↑+ Ca2++H2O |
| B.稀Fe(NO3)2溶液中加入稀盐酸:3Fe2++4H++NO3-= 3Fe3++NO↑+2H2O |
| C.Ca(ClO)2溶液中通入过量的SO2:C1O-+ SO2 + H2O =" HClO" + HSO3- |
| D.铜溶于FeCl3溶液中:Cu + 2Fe3+ ="2" Fe2+ + Cu2+ |
X、Y、M、N是短周期主族元素,且原子序数依次增大。已知X原子的最外层电子数是电子层数的3倍,X、M同主族,Y原子在短周期主族元素中原子半径最大。下列说法正确的是
| A.M与X的化合物对应的水化物一定是强酸 |
| B.Y2X和Y2X2中化学键类型相同,阴、阳离子的个数比相同 |
| C.气态氢化物的热稳定性:M > N |
| D.离子半径r:r(X2-)> r(Y+) |
下列说法正确的是
| A.将高温水蒸气通过炽热的铁粉,铁粉变红色 |
| B.向Fe(OH)3胶体中滴加稀H2SO4,先出现沉淀,后沉淀溶解 |
| C.将市售食盐溶于水,滴加淀粉溶液不变蓝色,说明不是加碘盐 |
| D.Cu的金属活泼性比Fe弱,故水库铁闸门上接装铜块可减缓铁腐蚀 |
关于常温下0.1 mol·L-1醋酸钠溶液,下列说法正确的是
| A.水电离出来的c(OH-)=1.0×10-13 mol·L-1 |
| B.该溶液的pH<13 |
| C.溶液中离子浓度关系:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| D.加入等浓度等体积的盐酸,溶液中:c(CH3COOH)+ c(CH3COO-)= c(Cl-)+ c(Na+) |
下列实验操作、现象和结论均正确的是
| 选项 |
操作 |
现象 |
结论 |
| A |
①将湿润的红色石蕊试纸靠近试管口 |
试纸不变色 |
NH4Cl受热不分解 |
| B |
②中振荡后静置 |
下层液体颜色变浅 |
NaOH溶液可除去溶在溴苯中的Br2 |
| C |
③加热 |
洗气瓶中溶液褪色 |
生成了乙烯 |
| D |
④通电 |
A极上有红色固体析出 |
锌的金属性比铜强 |
工业上合成有机物Ⅲ( )的路线如下:
)的路线如下:
(1)有机物Ⅰ的分子式为 ,所含官能团名称为 。
(2)反应①的反应类型为 ,反应②中无机试剂和催化剂为 。
(3)反应③的化学方程式为 。
(4)有机物Ⅳ发生消去反应可得Ⅰ,也能通过两步氧化得丙二酸,则Ⅳ的结构简式为 。
(5)已知(R表示烃基):
醛和酯也能发生上述类似反应,则苯甲醛与 发生反应,可直接合成有机物Ⅲ。
工业上用NH3和CO2反应合成尿素:
2NH3(g)+ CO2(g) CO(NH2)2(g)+ H2O(g) △H1 =" -536.1" kJ·mol-1
CO(NH2)2(g)+ H2O(g) △H1 =" -536.1" kJ·mol-1
(1)此反应的平衡常数表达式K= 。升高温度,K值 (填增大、减小或不变)。
(2)其他条件不变,下列方法能同时提高化学反应速率和尿素产率的是 。
| A.通入氦气 | B.缩小体积 |
| C.加入催化剂 | D.除去体系中的水蒸气 |
(3)尿素可用于处理汽车尾气。CO(NH2)2(g)与尾气中NO反应生成CO2、N2、H2O(g)排出。又知:4NH3(g)+ 6NO(g)= 5N2(g)+ 6H2O(g) △H2 =" -1806.4" kJ·mol-1,写出CO(NH2)2(g)与NO反应的热化学方程式 。
某小组模拟工业合成尿素,探究起始反应物的氨碳比[n(NH3)/n(CO2)]对尿素合成的影响。在恒温下1L容器中,将总物质的量为3mol的NH3和CO2以不同的氨碳比进行反应,实验测得平衡体系中各组分的变化如图所示。回答问题: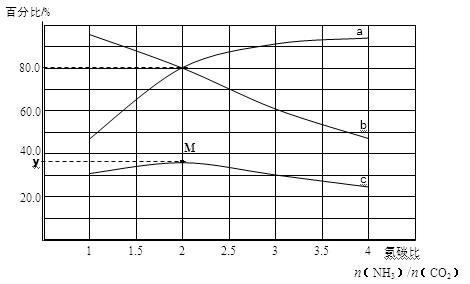
(4)若a、b线分别表示NH3或CO2转化率的变化,其中表示NH3转化率的是 (填a或b)线。
(5)若a、b线分别表示NH3或CO2转化率的变化,c线表示平衡体系中尿素体积分数的变化,求M点对应的y值(写出计算过程,结果精确到0.1)。
工业上回收利用某合金废料(主要含Fe、Cu、Co、Li等,已知Co、Fe都是中等活泼金属)的工艺流程如下:
(1)金属M为 ,操作1为 。
(2)加入H2O2的作用是(用离子方程式表示) ,加入氨水的作用是 。
(3)充分焙烧的化学方程式为 。
(4)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系见下表。操作2中,蒸发浓缩后必须趁热过滤,其原因是 ,90℃时Ksp(Li2CO3)的值为 。
| 温度/℃ |
10 |
30 |
60 |
90 |
| 浓度/mol・L-1 |
0.21 |
0.17 |
0.14 |
0.10 |
(5)用惰性电极电解熔融Li2CO3制取锂,阳极生成两种气体,则阳极的电极反应式为 。
甲、乙组同学分别做了以下探究实验。
(1)甲组探究Cl2与Na2SO3溶液反应,实验装置如下。
①请指出该装置的不足之处 、 。
②Cl2与Na2SO3溶液反应的离子方程式为 。
③设计实验,简述实验步骤,证明洗气瓶中的Na2SO3已被氧化 。
乙组探究乙酸乙酯(沸点77.1℃)在不同温度、不同浓度NaOH溶液中的水解速率。
取四支大小相同的试管,在试管外壁贴上体积刻度纸,按下表进行对照实验。在两种不同温度的水浴中加热相同时间后,记录酯层的体积来确定水解反应的速率。
④请完成上表,其中V2 = ,V4 = ,V5 = 。
⑤实验中,可用饱和食盐水替代蒸馏水,其优点是 ;但不能用饱和Na2CO3溶液替代蒸馏水,其原因是 。
⑥实验中,试管Ⅳ比试管Ⅱ中的酯层减少更快,其原因有:温度高速率快,还可能有 。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号