高二化学第十四套(山东选修四)
下列叙述正确的是( )
| A.O2和O3互为同位素,性质相似 |
| B.等质量的碳酸钠和碳酸氢钠粉末分别与足量同浓度的稀盐酸反应,前者产生的二氧化碳多,后者产生二氧化碳的速率慢 |
| C.明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同 |
| D.石墨(s) = 金刚石(s) △H>0,所以石墨比金刚石稳定 |
钢铁发生吸氧腐蚀时,负极上发生的电极反应是( )
| A.2H+ + 2e- = H2↑ | B.Fe = Fe2+ + 2e- |
| C.2H2O + O2 + 4e- = 4OH- | D.Fe3+ + e- = Fe2+ |
下列变化不能用勒夏特列原理解释的是( )
| A.工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率 |
B.已知反应H2(g) + I2(g) 2HI(g)达平衡,加压后混合气体颜色变深 2HI(g)达平衡,加压后混合气体颜色变深 |
| C.红棕色的NO2加压后颜色先变深再变浅 |
| D.实验室用排饱和食盐水的方法收集氯气 |
在恒温时,一固定容积的容器内发生反应:PCl5(g) PCl3 (g)+Cl2(g)。达到平衡时,再向容器内通入一定量PCl5 (g),重新达到平衡后,与第一次平衡时相比,Cl2的浓度( )
PCl3 (g)+Cl2(g)。达到平衡时,再向容器内通入一定量PCl5 (g),重新达到平衡后,与第一次平衡时相比,Cl2的浓度( )
| A.增大 | B.减小 | C.不变 | D.无法判断 |
下列各种环境下的离子组合中,离子不能大量共存的是( )
| A.无色中性溶液:Mg2+、Al3+、SO42-、Cl- |
| B.pH=0溶液:Al3+、NH4+、Mg2+、HSO4- |
| C.[H+]=10-10mol/L溶液:Na+、AlO2-、S2-、S2O32- |
| D.[H+]>[OH-]的溶液:Fe3+、ClO-、I-、NO3- |
已知H+(aq)+OH-(aq)=H2O(l);ΔH=" -57.3" kJ/mol。若向三份等体积、等物质的量浓度的NaOH溶液中分别加入:①稀醋酸;②浓硫酸;③稀硝酸至恰好完全反应,并将上述过程中放出的热量分别记为Ql、Q2、Q3。下列关系式中正确的是( )
| A.Q1<Q3<Q2 | B.Ql<Q2<Q3 | C.Q1<Q2=Q3 | D.Q1=Q2=Q3 |
在甲酸的下列性质中,可以证明它是弱电解质的是( )
| A.1mol/L甲酸溶液中c(H+)约为1×10-2mol/L |
| B.甲酸能与水以任意比互溶 |
| C.10mL 1mol/L甲酸恰好跟10 mL 1mol/L NaOH溶液完全反应 |
| D.甲酸的导电性比强酸溶液的导电性弱。 |
pH=a的某电解质溶液中,插入两只惰性电极,通直流电一段时间后,溶液的pH>a,则该电解质可能是( )
| A.H2SO4 | B.AgNO3 | C.Na2SO4 | D.NaOH |
有关阳离子交换膜电解饱和食盐水的(装置如图)说法正确的是( )

| A.转移电子0.8 mol时产生氢气8.96 L |
| B.从出口B处导出的是氢氧化钠与氯化钠的混合溶液 |
| C.装置中出口①处的气体能使湿润的淀粉碘化钾试纸变蓝 |
| D.装置中的阳离子交换膜防止产生的氯气与氢氧化钠溶液反应 |
下列叙述正确的是( )
| A.粗铜精炼时,把粗铜接在电源的负极 |
| B.充电时,把铅蓄电池的负极接在外电源的正极 |
| C.镀锡铁破损后铁更易被腐蚀 |
D.碱性氢氧燃料电池工作时,负极反应为: = =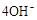 |
NA代表阿伏加德罗常数,下列说法正确的是( )
| A.如果5.6LN2含有n个氮分子,则阿伏加德罗常数一定约为4n |
| B.15.6gNa2O2与过量CO2反应时,转移的电子数为0.4NA |
| C.1L1mol/L的FeCl3溶液中,含有铁离子的数目为NA |
| D.T℃时,1LPH=6纯水中,含10-6NA个OH- |
在室温下等体积的酸和碱的溶液,混合后pH一定小于7的是( )
| A.pH=3的硝酸和pH=11的氢氧化钠溶液 |
| B.pH=3的盐酸和pH=11的氨水 |
| C.pH=3的硫酸和pH=11的氢氧化钠溶液 |
| D.pH=3的醋酸和pH=11的氢氧化钠溶液 |
为除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入一种试剂,过滤后,再向滤液中加入适量的盐酸,这种试剂是( )
| A.NH3·H2O | B.NaOH | C.Na2CO3 | D.MgCO3 |
在密闭容中发生下列反应aA(g) cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是( )
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是( )
| A.A的转化率增大 | B.平衡向正反应方向移动 |
| C.D的体积分数变大 | D.a < c+d |
常温下,把盐酸和氨水等体积混合后,其溶液的pH恰好等于7,则下列说法中正确的是( )
| A.盐酸中的c(H+)一定小于氨水中的c(OH-) |
| B.盐酸的物质的量浓度一定小于氨水的物质的量浓度 |
| C.反应后生成的盐溶液一定没有发生水解 |
| D.盐酸中HCl的物质的量一定等于NH3・H2O的物质的量 |
可逆反应:2NO2 2NO+O2在体积固定的密闭容器中,达到平衡状态的标志是( )
2NO+O2在体积固定的密闭容器中,达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
| A.①④⑥⑦ | B.②③⑤⑦ | C.①③④⑤ | D.全部 |
下列有关溶液中离子浓度的关系,不正确的是( )
| A.NaHCO3溶液中存在:c(OH-)=c(H2CO3)+c(H+) |
| B.常温下,pH=3的盐酸和pH=ll的氨水等体积混合后,溶液中:c(NH4+)>c(Cl-) |
| C.0.2 mol/LNH4Cl溶液与0.1 mol/L NaOH溶液等体积混合后,溶液中c(NH4+)>c(Na+) |
| D.0.2 mol/L 的CH3COOH 溶液中c(H+)小于0.1 mol/L 的CH3COOH 中c(H+)的两倍 |
某温度下,相同pH的盐酸和醋酸溶液分别加水稀释, pH 随溶液体积变化的曲线如图所示。据下图判断正确的是( )

| A.Ⅱ为盐酸稀释时的pH变化曲线 |
| B.a点KW的数值比c点KW的数值大 |
| C.b点溶液的导电性比c点溶液的导电性强 |
| D.b点酸的总浓度大于a点酸的总浓度 |
在一个绝热容器中,放入Ca(OH)2悬浊液,有平衡:
Ca(OH)2(s) Ca2+(aq)+2OH-(aq)ΔH<0 。
Ca2+(aq)+2OH-(aq)ΔH<0 。
已知:CaO(s)+H2O(l) = Ca(OH)2(s)ΔH<0 。下列说法正确的是( )
| A.向溶液中加少量CaO,达新平衡后,溶液的pH不变 |
| B.向溶液中加少量CaO,达新平衡后,溶液的pH降低 |
| C.向溶液中加入Na2CO3溶液,其中Ca(OH)2固体质量增加 |
| D.向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变 |
“嫦娥一号”的登月成功,实现了中国人“奔月”的梦想。
(1)2H2(g)+O2(g)=2H2O(l); H=-571.6kJ·mol-1
H=-571.6kJ·mol-1
C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1
C8H18(l)+12.5O2(g)=8CO2(g)+9H2O(l); H="-5518" kJ·mol-1
H="-5518" kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l)  H =-890kJ·mol-1
H =-890kJ·mol-1
相同质量的H2、C、 C8H18、CH4完全燃烧时,放出热量最多的是 。
(2) 氢气、氧气不仅燃烧能放出热量,二者形成的原电池还能提供电能。“嫦娥一号”绕月飞行部分使用的是氢氧燃料电池,电解质溶液为KOH溶液,其电极反应式为:
负极 ;正极 ;
(3)若用氢氧燃料电池电解100mL由NaCl 和CuSO4组成的混合溶液,其中[Na+]=3[Cu2+]=0.3mol·L-1,用石墨作电极,通电一段时间后,在阴极收集到0.112L H2(标况).
试计算:
①阴极析出Cu mol。阳极析出气体为 (填化学式)。
②若所得溶液仍然为100mL,则此时溶液的pH值为 。
按下图装置进行实验,并回答下列问题

(1)判断装置的名称:A池为___________ , B池为______________
(2)锌极为__________极,电极反应式为_______________ __________
(3)石墨棒C1为______极,电极反应式为__________ _____________
石墨棒C2附近发生的实验现象为________________ ____________
(4)当C2极析出224mL气体(标准状态)时,锌的质量减少_________g。
(1)研究硫及其化合物性质有重要意义。
硫酸工业生产中涉及如下反应:
2SO2(g)+O2(g) 2SO3(g)。
2SO3(g)。
向2L的容器中充入2molSO2、1molO2,SO2的平衡转化率与温度的关系
如图所示。T1温度时反应进行到状态D时,v(正) v(逆)(填“>”、“<”或“=”)。

温度为T1时,反应的平衡常数K= 。(单位必须写)若在T3温度时,达平衡时测得反应放出的热量为Q1。此时再向容器中加入2molSO2、1molO2并使之重新达到平衡,测得又放出热量Q2。则下列说法正确的是 。(填字母编号)
a.容器的压强增大原来的两倍
b.Q2一定等于Q1
c.新平衡时SO2的转化率一定大于80%
d.T3时的平衡常数大于T1时的平衡常数
(2)已知:25°C时,Ksp[Mg(OH)2]=5.6×10-12 Ksp(MgF2)=7.4×10-11 。 25°C时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+) (填增大、减小或不变);
25°C时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+) (填增大、减小或不变); 在等浓度的KOH和KF混合溶液中加入稀MgCl2溶液,首先生成的沉淀是 (写化学式)。
在等浓度的KOH和KF混合溶液中加入稀MgCl2溶液,首先生成的沉淀是 (写化学式)。
(3)Al2(SO4)3溶液显示酸性,其原因是 (写离子方程式),向某酸化的Al2(SO4)3溶液中加入NaHCO3固体,出现的现象是:有大量气体产生,同时有白色沉淀,试用平衡移动原理解释原因: 。
(4)加热蒸发下列溶液,能析出得到原溶质的是
a.KNO3溶液 b.AlCl3溶液 c.Al2(SO4)3溶液 d.盐酸
(5)25°C时,pH为4的氯化铵溶液和pH为4盐酸溶液中,由水电离出的H+浓度之比为 。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号