广东省潮州金中等五校高三联考理综化学试卷
下列说法正确的是
| A.乙酸乙酯和淀粉均可水解生成乙醇 |
| B.溴乙烷、苯酚一定条件下都能与NaOH水溶液发生反应 |
| C.苯、乙烯都能使酸性KMnO4溶液褪色 |
| D.葡萄糖和蔗糖溶液都能发生银镜反应 |
25℃时,下列各组离子在指定溶液中能大量共存的是
| A.pH=11的溶液中:Na+、K+、MnO4-、CO32- |
| B.滴入酚酞显红色的溶液中:Na+、Al3+、AlO2-、NO3- |
| C.0.1mol/LNH4HCO3溶液中:Na+、Al3+、NO3-、Cl- |
| D.0.1mol/LFeCl3溶液中:Fe2+、NH4+、SCN-、SO42- |
设NA为阿伏加德罗常数的值。下列叙述正确的是
| A.0.1 mol Cl2全部溶于水后转移电子的数目为0.1NA |
| B.标准状况下,0.56 L丙烷中含有共价键的数目为0.25NA |
| C.25℃时,1 L pH=12的Na2CO3溶液中含有Na+的数目为0.02NA |
| D.标准状况下,22.4LNH3溶于1L水中得到1.0mol/L氨水 |
在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是
| A.氯水的颜色呈浅黄绿色,说明氯水中含有Cl2 |
| B.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- |
| C.向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+ |
| D.向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO |
HF为一元弱酸,在0.1mol·L-1NaF溶液中,离子浓度关系不正确的是
| A.c(F-)>c(Na+)>c(OH-)>c(H+) | B.c(F-)+c(HF)=0.1mol·L-1 |
| C.c(OH-)=c(HF)+c(H+) | D.c(Na+)+c(H+)=c(F-)+c(OH-) |
实验证明:若用电解熔融KCl制钾,发现钾熔于熔融KCl中难分离,且电解过程中容易发生爆炸事故等。因而工业不用电解熔融KCl制钾,而用金属钠与KCl共熔置换制钾:
Na(l)+KCl(l) NaCl(l)+K(g) △H>0。 下面是四种物质的熔沸点:
NaCl(l)+K(g) △H>0。 下面是四种物质的熔沸点:
| |
K |
Na |
KCl |
NaCl |
| 熔点/℃ |
63.6 |
97.8 |
770 |
801 |
| 沸点/℃ |
774 |
882.9 |
1500 |
1413 |
根据平衡移动原理,可推知用Na与KCl反应制取金属钾的适宜温度是
A.低于770℃ B.约850℃ C.高于882.9℃ D.1413~1500℃
元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在冷暗处与H2剧烈化合并发生爆炸。则下列判断正确的是
| A.非金属性:Z<T<X |
| B.R与Q的电子数相差26 |
| C.气态氢化物稳定性:R <T<Q |
| D.最高价氧化物的水化物的酸性:T>Q |
下列实验操作、现象与结论对应关系正确的是
| 选项 |
实验操作 |
实验现象 |
结论 |
| A |
向盛有Fe(NO3)2溶液的试管中加入0.1 mol·L-1 H2SO4溶液 |
试管口出现红棕色气体 |
溶液中NO3-被 Fe2+还原为NO2 |
| B |
向溶液中先滴加稀盐酸,再滴加BaCl2溶液 |
先滴加稀盐酸无现象,滴加BaCl2后出现白色沉淀 |
溶液中一定含有SO42- |
| C |
在0.1mol·L-1CH3COONa溶液中,加两滴酚酞显浅红色,微热 |
红色加深 |
盐类水解是吸热反应 |
| D |
向淀粉溶液中加入稀H2SO4,水浴加热几分钟,冷却后再加入新制Cu(OH)2悬浊液,加热 |
无砖红色沉淀生成 |
淀粉没有水解生成葡萄糖 |
(16分)Heck反应是偶联反应的一种,例如:反应①:
化合物Ⅰ可以由以下途径合成:
(1)化合物Ⅱ的分子式为 ,1mol该物质最多可与 molH2发生加成反应。
(2)卤代烃CH3CHBrCH3发生消去反应可以生成化合物Ⅲ,相应的化学方程式为:
(注明条件)。
(3)化合物Ⅳ含有甲基且无支链的同系物Ⅵ的分子式为C4H6O,则化合物Ⅵ的结构简式为: 。
(4)化合物Ⅴ可与CH3CH2OH发生酯化反应生成化合物Ⅶ,化合物Ⅶ在一定条件下可以发生加聚反应,则其加聚产物的结构简式为: 。
(5)化合物Ⅱ的一种同分异构体Ⅷ能发生银镜反应,且核磁共振氢谱只有三组峰,峰面积之比为1:2:2,Ⅷ的结构简式为: 。
(6)一定条件下, 与
与 也可以发生类似反应①的反应,其有机产物的结构简式为: 。
也可以发生类似反应①的反应,其有机产物的结构简式为: 。
氮氧化物和SO2是造成雾霾天气的主要原因之一。
(1)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。
已知:H2(g)+1/2O2(g)=H2O(g)ΔH=-241.8kJ·mol-1,C(s)+1/2O2(g)=CO(g) ΔH=-110.5kJ·mol-1
写出焦炭与水蒸气高温反应的热化学方程式: 。
②洗涤含SO2的烟气。下列物质可作洗涤剂的是 (填字母)。
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(2)①已知汽车发动机工作时汽缸中生成NO的反应为:N2(g)+O2(g) 2NO(g) ΔH=+183kJ·mol-1。若1mol空气含0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡,测得NO为8×10-4mol。该温度下的平衡常数K= 。汽车启动后,汽缸温度越高,单位时间内NO排放量越大,请用反应速率和化学平衡知识解释NO排放量增大的原因: 。
2NO(g) ΔH=+183kJ·mol-1。若1mol空气含0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡,测得NO为8×10-4mol。该温度下的平衡常数K= 。汽车启动后,汽缸温度越高,单位时间内NO排放量越大,请用反应速率和化学平衡知识解释NO排放量增大的原因: 。
(3)硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时需经处理后才能排放。某校化学兴趣小组欲测定某硫酸工厂排放尾气中二氧化硫的含量,采用以下方案:如图所示,图中气体流量计B用于准确测量通过的尾气体积。
将尾气通入一定体积已知浓度的碘水中测定SO2的含量。当洗气瓶C中溶液蓝色消失时,立即关闭活塞A。
①洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验的准确度,其理由是 。
②洗气瓶C中溶液蓝色消失后,没有及时关闭活塞A,测得的SO2含量________(填“偏高”、“偏低”或“无影响”)。
(4)将某PM2.5样本用蒸馏水处理制成待测试液。若测得该试液所含水溶性无机离子的化学组分及其平均浓度[c(H+)、c(OH-)待测]如下表:
| 离子 |
K+ |
Na+ |
NH4+ |
SO42- |
NO3- |
Cl- |
| 浓度/mol·L-1 |
4×10-6 |
6×10-6 |
2×10-5 |
4×10-5 |
3×10-5 |
2×10-5 |
根据表中数据判断PM2.5的酸碱性为 ,待测试液的pH= 。
(16分)硫酸铅(PbSO4)广泛应用于制造铅蓄电池、白色颜料等。利用方铅矿精矿(PbS)直接制备硫酸铅粉末的流程如下: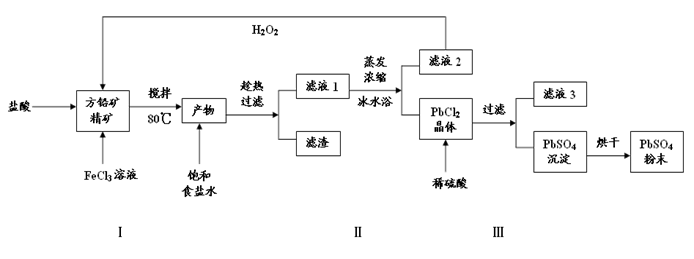
已知:(ⅰ)PbCl2(s)+2Cl-(aq) PbCl42- (aq) △H>0
PbCl42- (aq) △H>0
(ⅱ)Ksp(PbSO4)=1.08×10-8,Ksp(PbCl2)=1.6×10-5
(ⅲ)Fe3+、Pb2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、7.04
(1)步骤Ⅰ中FeCl3溶液与PbS反应生成PbCl2和S的离子方程式为 ,步骤Ⅰ中另一个反应是H2O2与FeCl2、盐酸反应生成FeCl3,实现FeCl3的重复利用,其离子方程式为 ,加入盐酸的另一个目的是为了控制pH在0.5~1.0,原因是 。
(2)用化学平衡移动的原理解释步骤Ⅱ中使用冰水浴的原因 。
(3)写出PbCl2晶体转化为PbSO4沉淀的离子方程式 。
(4)滤液3是 。
(5)铅蓄电池的电解液是稀硫酸(22%~28%),充电后两个电极上沉积的PbSO4分别转化为PbO2和Pb,铅蓄电池充电时阴极的电极反应式为 。
(16分)某研究小组想探究炭与浓硝酸的反应。其实验过程如下。
| 操作 |
现象 |
| a.用干燥洁净的烧杯取约10mL浓硝酸,加热。 |
|
| b.把小块烧红的木炭迅速放入热的浓硝酸中。 |
红热的木炭与热的浓硝酸接触发生剧烈反应,同时有大量红棕色气体产生,液面上木炭迅速燃烧,发出光亮,上下反复跳动。 |
(1)热的浓硝酸与红热的木炭接触会发生多个化学反应。
①炭与浓硝酸的反应,说明浓硝酸具有 性。
②反应产生的热量会使少量浓硝酸受热分解,该反应的化学方程式为 。
(2)实验现象中液面上木炭迅速燃烧,发出光亮。小组同学为了研究助燃气体是O2还是NO2,设计了以下实验。
Ⅰ.制取NO2气体。
①在虚线框内画出用铜与浓硝酸制取和收集NO2的装置简图(夹持仪器略)。
②NaOH溶液的作用是吸收多余的NO2,反应生成两种物质的量相等的正盐,写出反应的的离子方程式 。
Ⅱ.探究实验。
实验操作:在空气中引燃木炭,使其燃烧并带有火焰,将带火焰的木炭伸入盛有NO2气体的集气瓶中。
实验现象:木炭在NO2气体中持续燃烧,火焰迅速变亮,集气瓶中气体颜色变浅直至无色,产生的气体能使澄清石灰水变浑浊,且遇空气不变色。
①根据实验现象写出碳与NO2气体反应的化学方程式 。
②通过实验探究,你认为上表操作b中助燃气体是什么,简述理由 。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号