上海市闵行区八校高一上学期期中联考化学试卷
19世纪初,某科学家提出了原子学说,他认为物质由原子组成,原子不能被创造,也不能被毁灭,在化学反应中不能再分,这个科学家是
| A.汤姆生 | B.道尔顿 | C.卢瑟福 | D.波尔 |
下列氯化物中,不能用金属和氯气反应得到的是
| A.CuCl2 | B.FeCl2 | C.MgCl2 | D.NaCl |
某微粒用AZRn+表示,下列关于该微粒的叙述正确的是
| A.所含质子数 = A–n | B.所含中子数 = A–Z |
| C.所含电子数 = Z+n | D.质量数 = Z+A |
下列选项中,与氯气用途无关的是
| A.消毒杀菌 | B.制漂白粉 | C.制盐酸 | D.从海水中提取食盐 |
下列关于摩尔的说法中,正确的是
| A.是物质的量 | B.是一个物理量 |
| C.是一种物理量的单位 | D.是摩尔质量 |
市场上销售的“84”消毒液,其商品标识上注明;①本品为无色液体呈碱性;②使用时应加水稀释;③可对餐具、衣物进行消毒,可漂白浅色衣物。其有效成分可能是
| A.Cl2 | B.H2SO4 | C.NaClO | D.KMnO4 |
第四层为最外层时,该电子层最多容纳的电子数目是
| A.2个 | B.8个 | C.18个 | D.32个 |
下列各组微粒中,电子层数和最外层电子数都相同的是
| A.F-和Mg2+ | B.S和S2- | C.Al3+和Ar | D.He和H+ |
实验室制取气体时,发生装置相同的组合是
| A.HCl Cl2 | B.H2HCl |
| C.CO2 Cl2 | D.HCl CO2 |
X元素原子的核电荷数为n,X2-离子和Y3+离子的电子层结构相同,则Y原子的质子数为
| A.n+1 | B.n+2 | C.n+3 | D.n+5 |
下列各对物质中,互为同位素的是
①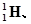
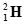 ②H2O、D2O ③
②H2O、D2O ③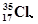
 ④金刚石、石墨 ⑤O2、O3 ⑥H2、H+
④金刚石、石墨 ⑤O2、O3 ⑥H2、H+
| A.①②③ | B.①③ | C.③④⑤ | D.④⑤⑥ |
在粗盐提纯实验中,要溶解10g粗盐,所需要量取水的体积最佳为(常温下氯化钠的溶解度为36g/100g水)
| A.100ml | B.40ml | C.50ml | D.30ml |
以下课堂实验中对实验现象描述正确的是
| A.铁丝在氯气中燃烧,放出大量的热,生成白色烟雾 |
| B.氢气在氯气中安静地燃烧,火焰呈浅蓝色,瓶口有白雾产生 |
| C.已吸入氯气的针筒中吸入氢氧化钠溶液,针筒内的气体体积迅速变小,黄绿色立即褪去 |
| D.在充满氯气的集气瓶中放入干燥的红色纸片,红色消失 |
铜有两种天然同位素63Cu和65Cu,已知铜元素的近似相对原子质量为63.5,则63Cu的原子个数百分数是
| A.75% | B.25% | C.50% | D.45% |
实验室进行NaCl溶液蒸发时,一般有以下操作过程:①放上蒸发皿;②放置酒精灯;③固定铁圈位置;④加热搅拌;⑤停止加热、余热蒸干。其正确操作的顺序是
| A.②①③④⑤ | B.①②③④⑤ | C.②③①④⑤ | D.③②①④⑤ |
设NA表示阿伏加德罗常数的值,下列说法正确的是
| A.NA个氧气分子与NA个氖气分子的质量比是4∶5 |
| B.17gOH-与19gH3O+所含电子数不相等 |
| C.14g14C和12g12C所含的中子数相等 |
| D.标准状况下,11.2LCO2与常温常压下8.5gNH3所含分子数相等 |
实验室用下列两种方法制氯气:①用含HCl 146g的浓盐酸与足量的MnO2反应;②用87gMnO2与足量浓盐酸反应。所得的氯气
| A.①比②多 | B.②比①多 | C.一样多 | D.无法比较 |
将蓝色石蕊试纸浸入氯水中后再取出,观察到的现象是
| A.蓝色不变 | B.试纸呈红色 |
| C.试纸先变红,再变白 | D.试纸立即变白 |
如果1g水中含有n个氢原子,则阿伏加德罗常数是
| A.n/1mol-1 | B.9n mol-1 | C.2nmol-1 | D.nmol-1 |
2.4克某金属和足量的氯气充分反应,所得固体比原金属增重7.1克,若该固体为单一价态的氯化物,则其化学式为
| A.NaCl | B.MgCl2 | C.FeCl3 | D.CuCl2 |
在常温常压下,将盛满氯气的一支试管倒立在水槽中,当日光长时间照射至不再反应为止,试管中最后残留气体体积占整个试管体积的
| A.1/2 | B.1/3 | C.1/4 | D.2/3 |
某元素原子的质量数为A,它的阴离子Xn-核外有x个电子,w克这种元素的原子核内中子数为
A. |
B.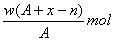 |
C. |
D. |
根据下列几种粒子的结构示意图,回答问题:(填元素符号或离子符号)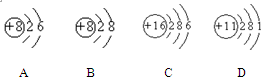
(1)其中属于阴离子的是 ,
(2)属于金属元素的是 ,
(3)具有相似化学性质的是 .
0.3 mol的氧气和0.2 mol的臭氧(O3),(1)它们的质量比 ,
(2)它们所含的分子数比 ,
(3)它们所含的原子数比 ,
(4)它们同温同压时的体积比是 。
市售的漂粉精的有效成分是 ,它在潮湿的空气里,发生化学反应的方程式是 ,写出工业上制取漂粉精的化学方程式: 。将氯气制成漂粉精的主要目的是: 。
A、B、C、D、E五种元素,它们的核电荷数依次增大,且均小于20。其中C、E是金属元素,A、E的最外层上都只有一个电子,B、D元素原子最外层电子数相同,且B元素L层电子数是K层的3倍,C元素最外层电子数是D最外层电子数的一半。回答下列问题:
(1)写出它们的元素符号:A ; C ;D 。
(2)写出B原子的电子式: 。
(3)画出C元素离子的结构示意图: 。
(4)写出与E元素离子具有相同核外电子排布的两个微粒的符号: 和 。
海水中含有丰富的化学资源。食盐是海水中的重要资源,海水在浓缩过程中析出盐的种类和质量如下表(单位g/L):
| 海水密度(g/ml) |
CaSO4 |
NaCl |
MgCl2 |
MgSO4 |
NaBr |
| 1.13 |
0.56 |
|
|
|
|
| 1.20 |
0.91 |
|
|
|
|
| 1.21 |
0.05 |
3.26 |
0.004 |
0.008 |
|
| 1.22 |
0.015 |
9.65 |
0.01 |
0.04 |
|
| 1.26 |
0.01 |
2.64 |
0.022 |
0.02 |
0.04 |
| 1.31 |
|
1.40 |
0.54 |
0.03 |
0.06 |
(1)现代产盐常用 方法从海水中得到食盐。
(2)为了得到含较少杂质的的粗盐,实际生产中卤水的密度控制在 范围之内。
(3)由上表可知先析出的物质是 。
(4)粗盐中常含有MgCl2、MgSO4和CaSO4等杂质,在实验室中依次加入 (填“序号”)等试剂,能将上述杂质除去。
a.BaCl2 b.NaOH c.Na2CO3 d.HCl
在“电解饱和食盐水”的实验探究中,将有关实验现象所得结论填入下表。
| |
实验现象 |
结论 |
| ① |
通电后,铁棒和石墨棒上都有气泡冒出 |
|
| ② |
将阴极上方收集的气体靠近火焰,有爆鸣声 |
|
| ③ |
阳极收集到的气体呈黄绿色,可使湿润的淀粉KI试纸变蓝 |
|
| ④ |
铁棒一端的溶液滴加酚酞后变红 |
|
电解饱和食盐水的化学方程式为: 。
下图中A、B、C是常见的化学实验装置,请回答下列问题: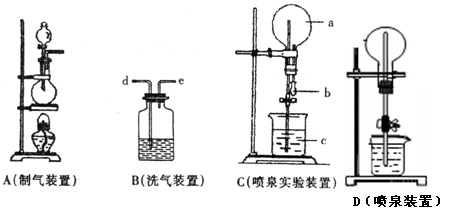
(1)实验里用A装置加热制取氯气,为得到纯净干燥的氯气,可让A中出来的气体在进入收集装置前依次分别通过装有 和 的两个洗气瓶B,作用是分别除去氯气中的杂质 和 , 尾气应通入 溶液,作用是 ,反应的化学方程式为 ,
(2)若C装置中圆底烧瓶a里充满了纯净、干燥的HCl气体,b、c为滴有石蕊试液的水,则引发水上喷的操作是 ,该实验的原理是 。
(3)如果只提供如图D的装置,进行HCl的喷泉实验,请说明引发喷泉的方法: 。
(4)若C装置中圆底烧瓶里充满了纯净、干燥的氯气,现用该装置做喷泉实验,则b、c中应盛的液体为 (写物质的名称)
 粤公网安备 44130202000953号
粤公网安备 44130202000953号