2023年全国统一高考化学试卷(辽宁卷)
科技是第一生产力,我国科学家在诸多领域取得新突破,下列说法错误的是( )
| A. |
利用 合成了脂肪酸:实现了无机小分子向有机高分子的转变 |
| B. |
发现了月壤中的“嫦娥石 ”:其成分属于无机盐 |
| C. |
研制了高效率钙钛矿太阳能电池,其能量转化形式:太阳能→电能 |
| D. |
革新了海水原位电解制氢工艺:其关键材料多孔聚四氟乙烯耐腐蚀 |
下列化学用语或表述正确的是( )
| A. |
的空间结构: 形 |
| B. |
中的共价键类型:非极性键 |
| C. |
基态 原子价电子排布式: |
| D. |
顺
丁烯的结构简式: |
下列鉴别或检验不能达到实验目的是( )
| A. |
用石灰水鉴别 与 |
| B. |
用 溶液检验 是否变质 |
| C. |
用盐酸酸化的 溶液检验 是否被氧化 |
| D. |
加热条件下用银氨溶液检验乙醇中是否混有乙醛 |
我国古代四大发明之一黑火药的爆炸反应为: 。设 为阿伏伽德罗常数的值,下列说法正确的是( )
| A. |
含 键数目为 |
| B. |
每生成 转移电子数目为 |
| C. |
晶体中含离子数目为 |
| D. |
溶液中含 数目为 |
在光照下,螺吡喃发生开、闭环转换而变色,过程如图。下列关于开、闭环螺吡喃说法正确的是( )
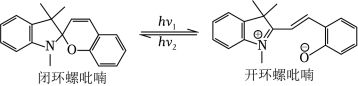
| A. |
均有手性 |
| B. |
互为同分异构体 |
| C. |
原子杂化方式相同 |
| D. |
闭环螺吡喃亲水性更好 |
某无隔膜流动海水电解法制 的装置如图所示,其中高选择性催化剂 可抑制 产生。下列说法正确的是( )
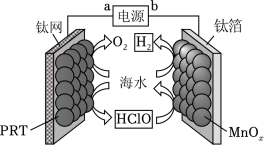
| A. |
端电势高于 端电势 |
| B. |
理论上转移 生成 |
| C. |
电解后海水 下降 |
| D. |
阳极发生: |
冠醚因分子结构形如皇冠而得名,某冠醚分子 可识别 ,其合成方法如图。下列说法错误的是( )
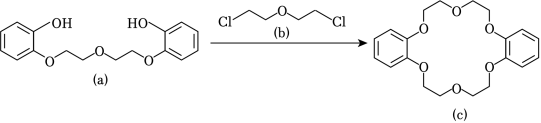
| A. |
该反应为取代反应 |
| B. |
均可与 溶液反应 |
| C. |
核磁共振氢谱有 组峰 |
| D. |
可增加 在苯中的溶解度 |
某种镁盐具有良好的电化学性能,其阴离子结构如图所示。 是核电荷数依次增大的短周期元素, 原子序数之和等于 , 原子价电子数是 原子价电子数的 倍。下列说法错误的是( )
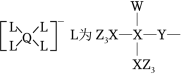
| A. |
与 的化合物为极性分子 |
| B. |
第一电离能: |
| C. |
的氧化物是两性氧化物 |
| D. |
该阴离子中含有配位键 |
某工厂采用如图工艺制备 ,已知焙烧后 元素以 价形式存在,下列说法错误的是( )
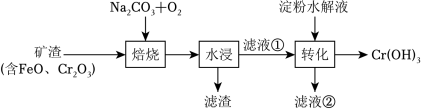
| A. |
“焙烧”中产生 |
| B. |
滤渣的主要成分为 |
| C. |
滤液①中 元素的主要存在形式为 |
| D. |
淀粉水解液中的葡萄糖起还原作用 |
某低成本储能电池原理如图所示。下列说法正确的是( )
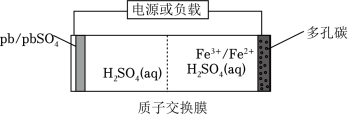
| A. |
放电时负极质量减小 |
| B. |
储能过程中电能转变为化学能 |
| C. |
放电时右侧 通过质子交换膜移向左侧 |
| D. |
充电总反应: |
一定条件下,酸性 溶液与 发生反应, (Ⅱ)起催化作用,过程中不同价态含 粒子的浓度随时间变化如图所示。下列说法正确的是( )

| A. |
(Ⅲ)不能氧化 |
| B. |
随着反应物浓度的减小,反应速率逐渐减小 |
| C. |
该条件下, (Ⅱ)和 (Ⅶ)不能大量共存 |
| D. |
总反应为: |
某小组进行实验,向
蒸馏水中加入
,充分振荡,溶液呈浅棕色,再加入
锌粒,溶液颜色加深;最终紫黑色晶体消失,溶液褪色。已知 为棕色,下列关于颜色变化的解释错误的是( )
为棕色,下列关于颜色变化的解释错误的是( )
|
选项 |
颜色变化 |
解释 |
|
A |
溶液呈浅棕色 |
在水中溶解度较小 |
|
B |
溶液颜色加深 |
发生了反应: |
|
C |
紫黑色晶体消失 |
的消耗使溶解平衡 右移 |
|
D |
溶液褪色 |
与有色物质发生了置换反应 |
| A. |
A |
B. |
B |
C. |
C |
D. |
D |
晶体结构的缺陷美与对称美同样受关注。某富锂超离子导体的晶胞是立方体(图1),进行镁离子取代及卤素共掺杂后,可获得高性能固体电解质材料(图2)。下列说法错误的是( )
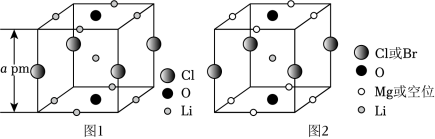
| A. |
图1晶体密度为 |
| B. |
图1中 原子的配位数为 |
| C. |
图2表示的化学式为 |
| D. |
取代产生的空位有利于 传导 |
某废水处理过程中始终保持 饱和,即 ,通过调节 使 和 形成硫化物而分离,体系中 与 关系如图所示, 为 和 的浓度,单位为 。已知 ,下列说法正确的是( )
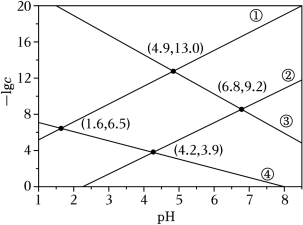
| A. |
|
| B. |
③为 与 的关系曲线 |
| C. |
|
| D. |
|
某工厂采用如图工艺处理镍钴矿硫酸浸取液(含 和 )。实现镍、钴、镁元素的回收。
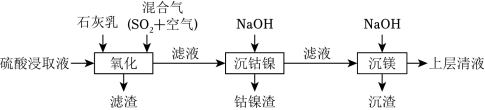
已知:
|
物质 |
Fe(OH)3 |
Co(OH)2 |
Ni(OH)2 |
Mg(OH)2 |
|
Ksp |
10﹣37.4 |
10﹣14.7 |
10﹣14.7 |
10﹣10.8 |
回答下列问题:
(1)用硫酸浸取镍钴矿时,提高浸取速率的方法为 __________(答出一条即可)。
(2)“氧化”中,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸( ), 中过氧键的数目为__________。
(3)“氧化”中,用石灰乳调节 , 被 氧化为 ,该反应的离子方程式为__________( 的电离第一步完全,第二步微弱);滤渣的成分为 、__________(填化学式)。
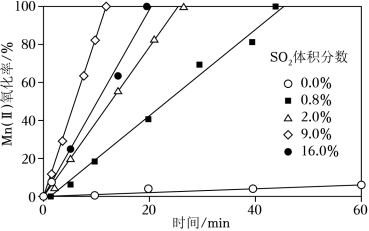
(4)“氧化”中保持空气通入速率不变, (Ⅱ)氧化率与时间的关系如图。 体积分数为__________时, (Ⅱ)氧化速率最大;继续增大 体积分数时, (Ⅱ)氧化速率减小的原因是__________。
(5)“沉钴镍”中得到的 (Ⅱ)在空气中可被氧化成 ,该反应的化学方程式为__________。
(6)“沉镁”中为使 沉淀完全( ),需控制 不低于__________(精确至 )。
2﹣噻吩乙醇( )是抗血栓药物氯吡格雷的重要中间体,其制备方法如图:

Ⅰ.制钠砂。向烧瓶中加入 液体A和 金属钠,加热至钠熔化后,盖紧塞子,振荡至大量微小钠珠出现。
Ⅱ.制噻吩钠。降温至 ,加入 噻吩,反应至钠砂消失。
Ⅲ.制噻吩乙醇钠。降温至 ,加入稍过量的环氧乙烷的四氢呋喃溶液,反应 。
Ⅳ.水解。恢复室温,加入 水,搅拌 ;加盐酸调 至 ,继续反应 ,分液;用水洗涤有机相,二次分液。
Ⅴ.分离。向有机相中加入无水 ,静置,过滤,对滤液进行蒸馏,蒸出四氢呋喃、噻吩和液体A后,得到产品 。
回答下列问题:
(1)步骤Ⅰ中液体A可以选择__________。
| A. |
乙醇 |
| B. |
水 |
| C. |
甲苯 |
| D. |
液氨 |
(2)噻吩沸点低于吡咯(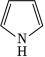 )的原因是__________。
)的原因是__________。
(3)步骤Ⅱ的化学方程式为__________。
(4)步骤Ⅲ中反应放热,为防止温度过高引发副反应,加入环氧乙烷溶液的方法是__________。
(5)步骤Ⅳ中用盐酸调节 的目的是__________。
(6)下列仪器在步骤Ⅴ中无需使用的是__________(填名称);无水 的作用为__________。

(7)产品的产率为__________(用 计算,精确至 )
硫酸工业在国民经济中占有重要地位。
(1)我国古籍记载了硫酸的制备方法——“炼石胆( )取精华法”。借助现代仪器分析,该制备过程中 分解的TG曲线(热重)及 曲线(反映体系热量变化情况,数值已省略)如图所示。 左右有两个吸热峰,则此时分解生成的氧化物有 、_____和_____(填化学式)。
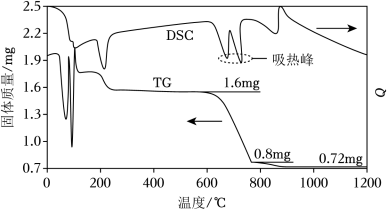
(2)铅室法使用了大容积铅室制备硫酸( 以下),副产物为亚硝基硫酸,主要反应如下:
ㅤ
(i)上述过程中 的作用为_____。
(ii)为了适应化工生产的需求,铅室法最终被接触法所代替,其主要原因是__________(答出两点即可)。
(3)接触法制硫酸的关键反应为 的催化氧化:
(i)为寻求固定投料比下不同反应阶段的最佳生产温度,绘制相应转化率( )下反应速率(数值已略去)与温度的关系如图所示,下列说法正确的是_____。
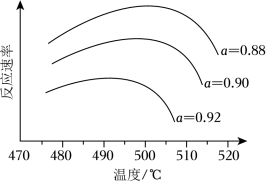
| A. |
温度越高,反应速率越大 |
| B. |
的曲线代表平衡转化率 |
| C. |
越大,反应速率最大值对应温度越低 |
| D. |
可根据不同 下的最大速率,选择最佳生产温度 |
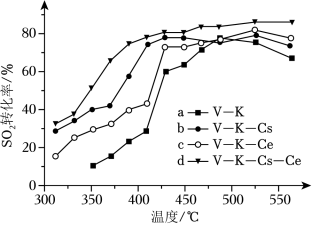
(ii)为提高钒催化剂的综合性能,我国科学家对其进行了改良。不同催化剂下,温度和转化率关系如图所示,催化性能最佳的是_____(填标号)。
(iii)设 的平衡分压为 , 的平衡转化率为 ,用含 和 的代数式表示上述催化氧化反应的 _____(用平衡分压代替平衡浓度计算)。
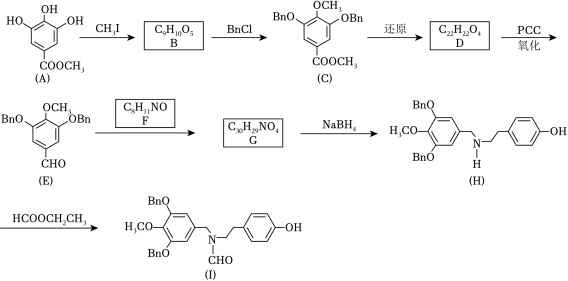
加兰他敏是一种天然生物碱,可作为阿尔茨海默症的药物,其中间体的合成路线如图。
已知:①
为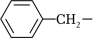
②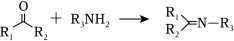 (
为烃基,
为烃基或
)
(
为烃基,
为烃基或
)
回答下列问题:
(1)A中与卤代烃成醚活性高的羟基位于酯基的_____位(填“间”或“对”)。
(2)C发生酸性水解,新产生的官能团为羟基和_____(填名称)。
(3)用 代替 完成D→E的转化,化学方程式为_____。
(4)F的同分异构体中,红外光谱显示有酚羟基、无 键的共有_____种。
(5)H→I的反应类型为_____。
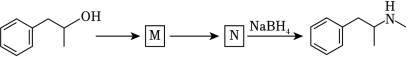
(6)某药物中间体的合成路线如图(部分反应条件已略去),其中M和N的结构简式分别为_____和_____。



 粤公网安备 44130202000953号
粤公网安备 44130202000953号